Toptailieu.vn xin giới thiệu Lý thuyết Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base (Cánh diều) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base (Cánh diều) hay, chi tiết | Lý thuyết Hóa học 11
Bài giải Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
A. Lý thuyết Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
I. Sự điện li, chất điện li và chất không điện li
1. Sự điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
2. Chất điện li và chất không điện li
- Chất điện li là những chất khi tan trong nước phân li ra các ion
- Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, ..
- Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol….
II. Thuyết Bronsted – Lowry về acid – base
1. Thuyết Bronsted – Lowry về acid – base
a. Khái niệm acid – base theo thuyết Bronsted – Lowry.
- Acid là chất cho proton (H+).
- Base là chất nhận proton (H+).
b. Ưu điểm của thuyết Bronsted – Lowry.
Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH3 hay CO3- cũng là base).
2. Acid mạnh / base mạnh và acid yếu / base yếu
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là:
+ Các acid mạnh: HCl, H2SO4, HNO3…
+ Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2…
+ Hầu hết các muối.
Phản ứng: Một chiều.
Biểu diễn: Mũi tên một chiều (→).
VD: HNO3 → H+ + NO3-.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là:
+ Các acid yếu: CH3COOH, HClO, HF, H2SO3…
+ Base yếu: Cu(OH)2, Fe(OH)2…
Phản ứng: Thuận nghịch.
Biểu diễn: Hai nửa mũi tên ngược nhau (⇆)
VD: CH3COOH ⇆ CH3COO- + H+.
Sơ đồ tư duy Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
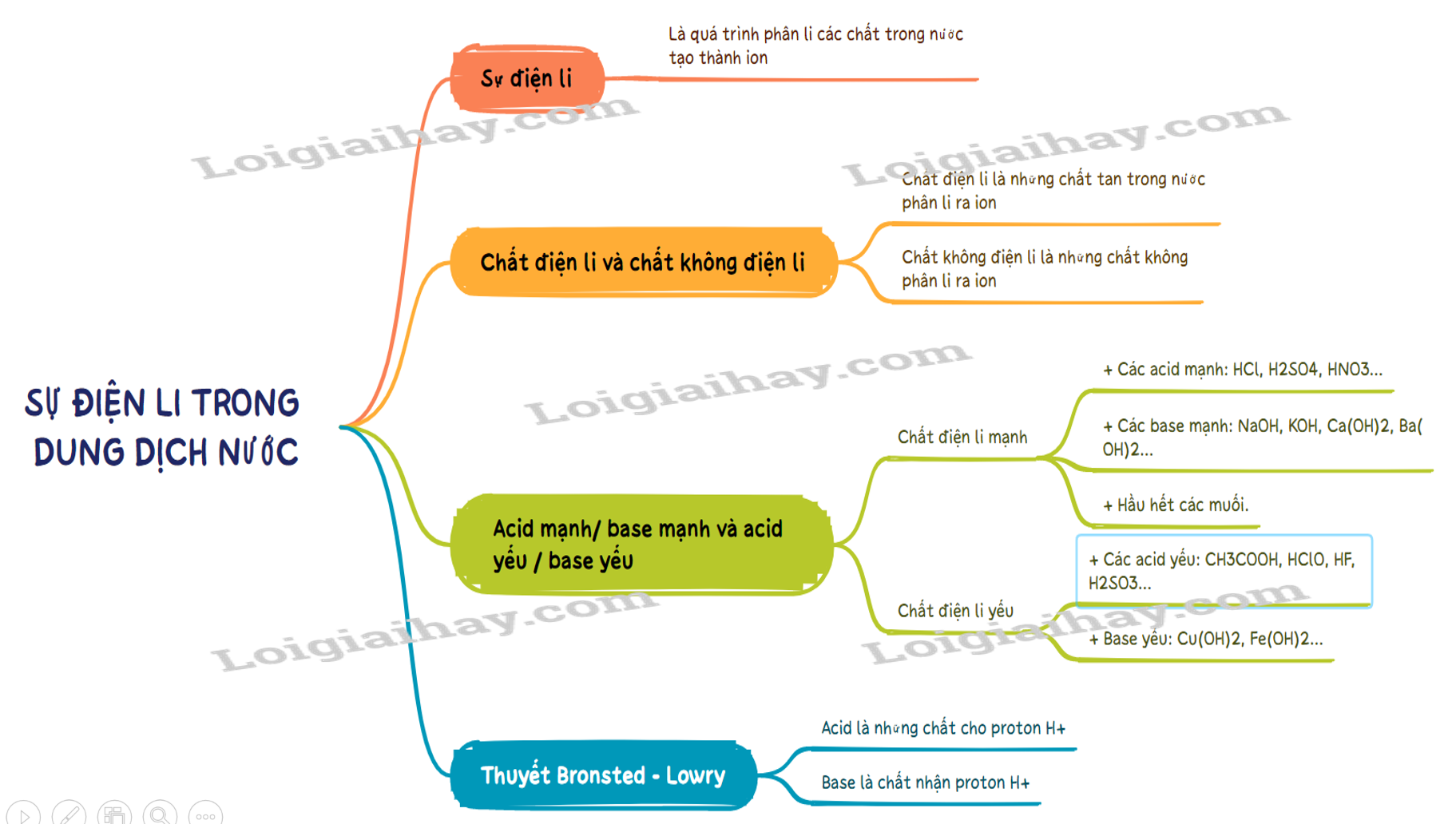
B. Trắc nghiệm Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Đang cập nhật...
Xem thêm Lý thuyết các bài Hoá học 11 Cánh Diều hay, chi tiết khác:
Lý thuyết Bài 1: Mở đầu về cân bằng hoá học
Lý thuyết Bài 3: pH của dung dịch. Chuẩn độ acid – base
Lý thuyết Bài 4: Đơn chất nitrogen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.