Với giải Bài tập trang 42 Hóa học lớp 10 Cánh Diều chi tiết trong Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử
Câu hỏi 1 trang 39 Hóa học 10: Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Lời giải:
- Các nguyên tố chu kì 2 có 2 lớp electron.
- Mô hình nguyên tử của Li (Z = 3) và F (Z = 9) theo Rutherford – Bohr như sau:
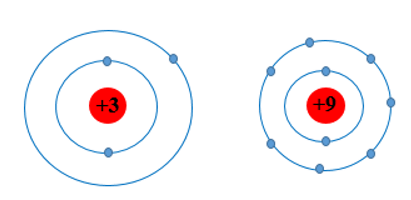
Li và F đều cùng có 2 lớp electron, tuy nhiên điện tích hạt nhân của F lớn hơn Li nên hạt nhân của F sẽ hút electron lớp ngoài cùng mạnh hơn làm cho bán kính nguyên tử F nhỏ hơn Li.
Xem thêm các bài giải Hóa học lớp 10 Cánh Diều hay, chi tiết khác:
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi...
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi...
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 6: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.