Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M
Bài 4 trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Zn + H2SO4 → ZnSO4 + H2
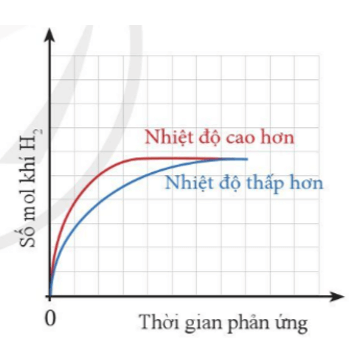
Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên.
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh.
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Lời giải:
a) Đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh do: Nhiệt độ càng cao, tốc độ phản ứng càng lớn, khí thoát ra càng nhiều.
b) Sau một thời gian, hai đồ thị lại chụm lại với nhau do phản ứng đã dừng lại (một hoặc cả hai các chất tham gia phản ứng hết). Do cùng lượng kim loại và H2SO4 cùng thể tích, nồng độ nên lượng khí thu được là như nhau ở cả 2 trường hợp.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Vận dụng 4 trang 94 Hóa học 10: Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
Bài 17: Nguyên tố đơn chất halogen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.