Với giải Câu hỏi trang 95 SGK Hoá học10 Chân trời sáng tạo trong Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Chân trời sáng tạo trang 95 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Câu hỏi 2 trang 95 Hóa học 10: Trong tự nhiên và cuộc sống, ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau; với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau. Tìm các ví dụ minh họa cho 2 nhận định trên.
Lời giải:
- Ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Trong cùng một môi trường nhiệt độ phòng:
+ Quá trình oxi hóa sắt (cửa sắt) tạo gỉ sắt xảy ra chậm (vài tháng hoặc vài năm).
+ Quá trình oxi hóa thức ăn xảy ra nhanh (vài tiếng, 1 ngày hoặc vài ngày).
- Với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Rau được bảo quản trong tủ lạnh sẽ giữ được lâu hơn rau để bên ngoài.
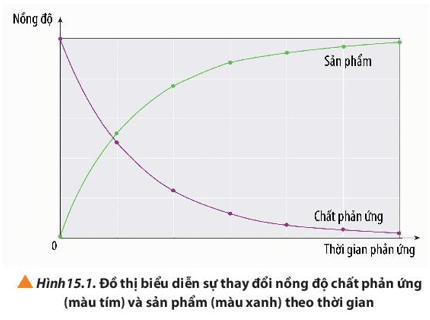
Lời giải:
- Nồng độ của chất phản ứng giảm dần theo thời gian.
- Nồng độ của chất sản phẩm tăng dần theo thời gian.
Luyện tập trang 95 Hóa học 10: Xét phản ứng phân hủy N2O5 ở 45oC: N2O5(g) → N2O4(g) + O2(g). Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tính tốc độ trung bình của phản ứng theo N2O4 trong khoảng thời gian trên
Lời giải:
= 1,36.10-3 (M/s)
Vậy tốc độ trung bình của phản ứng theo N2O4 trong 184 giây đầu tiên là 1,36.10-3 (M/s)
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 94 Hóa học 10: Trong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm..
Luyện tập trang 95 Hóa học 10: Xét phản ứng phân hủy N2O5 ở 45oC: N2O5(g) → N2O4(g) + O2(g). Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M...
Luyện tập trang 96 Hóa học 10: Cho phản ứng đơn giản sau: H2(g) + Cl2(g) → 2HCl(g)...
Bài 1 trang 97 Hóa học 10: Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g)..
Bài 3 trang 97 Hóa học 10: Cho phản ứng: 2N2O5(g) → 4NO2(g) + O2(g). Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30 M lên 0,40 M...
Xem thêm các bài giải SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 16: Các yếu tố ảnh hướng đến tốc độ phản ứng hoá học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.