Với giải Câu hỏi trang 45 SGK Hoá học10 Cánh Diều Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 45 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau:
a) Trong một chu kì, theo chiều ...(1)... điện tích hạt nhân, độ âm điện của các nguyên tố có xu hướng tăng dần, tính base của các hydroxide của các nguyên tố có xu hướng ...(2)... dần.
c) Nhóm ...(3)... là nhóm chứa các nguyên tố đứng đầu mỗi chu kì trong bảng tuần hoàn. Trong nhóm này, nguyên tử nguyên tố ...(4)... có bán kính lớn nhất. Số lượng các nguyên tố là kim loại của nhóm này là ...(5)...
Lời giải:
(1) tăng
(2) giảm
(3) kim loại kiềm (kim loại điển hình)
(4) Francium (Fr)
(5) 6
(1) Dễ nhường electron
(2) Dễ nhận electron
(3) Oxide cao nhất có tính base
(4) Oxide cao nhất có tính acid
Lời giải:
Đặc trưng thuộc về kim loại nhóm A là:
(1) Dễ nhường electron
(3) Oxide cao nhất có tính base
Đặc trưng thuộc về phi kim là:
(2) Dễ nhận electron
(4) Oxide cao nhất có tính acid
a) H3PO4 + Na2SO4 → ?
b) HNO3 + Na2CO3 → ?
Lời giải:
Trong hai phản ứng trên, phản ứng (b) xảy ra còn phản ứng (a) không xảy ra.
Giải thích:
Phản ứng a) không xảy ra do H3PO4 là acid trung bình nên không đẩy được H2SO4 là acid mạnh ra khỏi muối.
Phản ứng b) xảy ra do HNO3 là acid mạnh nên đẩy được H2CO3 là acid rất yếu ra khỏi muối.
Bài 4 trang 45 Hóa học 10: Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:
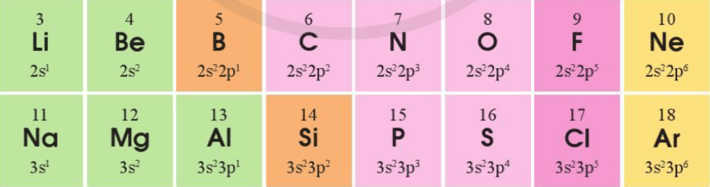
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tính tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi đó.
Lời giải:
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 thể hiện như sau: Đi từ trái qua phải theo chiều tăng dần điện tích hạt nhân nguyên tử, số electron lớp ngoài cùng tăng dần từ 1 đến 8.
b*) Vì với các nguyên tố chu kỳ 2 và 3 electron hóa trị tham gia vào việc hình thành liên kết hóa học cũng là electron ở lớp ngoài cùng. Do đó, sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tính tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3
Một số ví dụ để minh họa sự biến đổi tính chất hóa học của đơn chất và hợp chất:
+ Trong chu kì 2, theo chiều từ trái sang phải (chiều tăng của điện tích hạt nhân), tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim tăng dần. Điều này cũng được lặp lại ở các chu kì khác.
+ Trong chu kì 2, theo chiều tăng của điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần. Điều này cũng được lặp lại ở các chu kì khác.
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi...
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 6: Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.