Với giải Câu hỏi trang 98 SGK Hoá học10 Cánh Diều Bài 16: Tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 98 Bài 16: Tốc độ phản ứng
Bài 1 trang 98 Hóa học 10: Nồi áp suất dùng để ninh, hầm thức ăn có thể làm nóng nước tới nhiệt độ 120oC so với 100oC khi dùng nồi thường. Trong quá trình hầm xương thường diễn ra nhiều phản ứng hóa học, ví dụ quá trình biến đổi các protein, chẳng hạn như thủy phân một phần collagen thành gelatin. Hãy cho biết tốc độ quá trình thủy phân collagen thành gelatin thay đổi như thế nào khi sử dụng nồi áp suất thay cho nồi thường.
A. Không thay đổi.
B. Giảm đi 4 lần.
C. Ít nhất tăng 4 lần.
D. Ít nhất giảm 16 lần.
Lời giải:
Áp dụng mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ ta có:
Trong đó giá trị γ = 2 – 4
Với γ = 2 ⇒ = 4
Vậy tốc độ quá trình thủy phân collagen thành gelatin sẽ tăng lên ít nhất 4 lần khi sử dụng nồi áp suất thay cho nồi thường.
Bài 2 trang 98 Hóa học 10: Hình ảnh bên minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng? Giải thích.
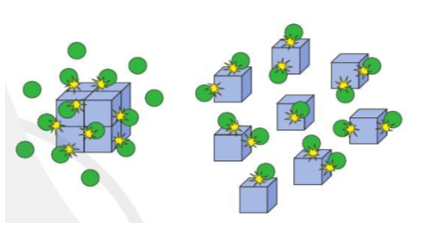
Lời giải:
Hình ảnh bên minh họa ảnh hưởng của diện tích tiếp xúc tới tốc độ phản ứng.
Giả sử khối lập phương là chất X, quả cầu màu xanh là chất Y.
Khi chất X được chia nhỏ, số va chạm của chất X và chất Y (trong cùng một đơn vị thời gian) sẽ lớn hơn, từ đó tốc độ phản ứng tăng.
Bài 3 trang 98 Hóa học 10: Khí H2 có thể được điều chế bằng cách cho miếng sắt vào dung dịch HCl. Hãy đề xuất các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2 từ cách này.
Lời giải:
Phương trình hóa học của phản ứng:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Để làm tăng tốc độ điều chế khí H2 ta có thể:
- Tăng nồng độ dung dịch HCl.
- Dùng sắt bột và khuấy nhẹ trong quá trình phản ứng.
- Đun nóng ống nghiệm chứa hỗn hợp Fe và HCl
Bài 4 trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Zn + H2SO4 → ZnSO4 + H2
Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên.
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh.
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
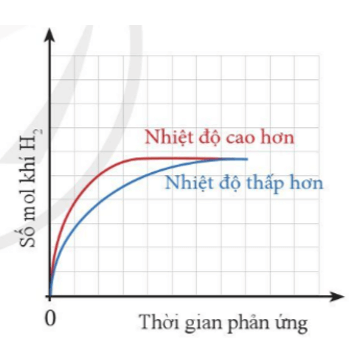
Lời giải:
a) Đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh do: Nhiệt độ càng cao, tốc độ phản ứng càng lớn, khí thoát ra càng nhiều.
b) Sau một thời gian, hai đồ thị lại chụm lại với nhau do phản ứng đã dừng lại (một hoặc cả hai các chất tham gia phản ứng hết). Do cùng lượng kim loại và H2SO4 cùng thể tích, nồng độ nên lượng khí thu được là như nhau ở cả 2 trường hợp.
Bài 5 trang 98 Hóa học 10: Phản ứng A →sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0; t = 1 phút; t = 2 phút lần lượt là 0,1563 M; 0,1496 M; 0,1431 M.
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và từ phút thứ nhất tới hết phút thứ hai.
b) Vì sao hai giá trị tốc độ tính được không bằng nhau.
Lời giải:
a) Tốc độ trung bình của phản ứng trong phút thứ nhất là
= = 1,12.10-4 (M.s-1)
Tốc độ trung bình của phản ứng từ phút thứ nhất tới hết phút thứ hai là
= = 1,08.10-4 (M.s-1)
b) Đa số các phản ứng hóa học có nồng độ giảm dần theo thời gian.
Nồng độ của chất phản ứng càng lớn thì tốc độ phản ứng càng lớn. Càng về sau nồng độ của chất A càng giảm nên tốc độ của phản ứng cũng giảm dần.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Mở đầu trang 88 Hóa học 10: Cho hai mảnh Mg cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl ở mỗi ống nghiệm lần lượt là 2M...
Câu hỏi 1 trang 89 Hóa học 10: Trong cùng một khoảng thời gian, nồng độ của MgCl2 trong dung dịch ở thí nghiệm nào tăng lên nhanh hơn? Giải thích...
Câu hỏi 2 trang 89 Hóa học 10: Tốc độ của phản ứng (1) ở thí nghiệm (a) là nhanh hơn hay chậm hơn tốc độ phản ứng ở thí nghiệm (b)?...
Câu hỏi 3 trang 90 Hóa học 10: Cho biết tốc độ phản ứng chỉ nhận giá trị dương. Giải thích tại sao phải thêm dấu trừ trong biểu thức (3) khi tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng...
Luyện tập 1 trang 90 Hóa học 10: Tính tốc độ trung bình của phản ứng (4) theo O2 trong 100 giây đầu tiên...
Luyện tập 2 trang 90 Hóa học 10: Từ bảng 6.1, có thể tính được tốc độ trung bình của phản ứng sau 50 giây hay không? Vì sao?...
Vận dụng 1 trang 90 Hóa học 10: Hãy sắp xếp tốc độ các phản ứng sau theo chiều tăng dần: (1) phản ứng than cháy trong không khí, (2) phản ứng gỉ sắt, (3) phản ứng nổ của khí bình gas...
Thực hành trang 91 Hóa học 10: Cho hai mẩu đá vôi từ cùng một mẫu có kích thước xấp xỉ nhau vào hai ống nghiệm chứa cùng một thể tích dung dịch HCl...
Vận dụng 2 trang 91 Hóa học 10: Thực phẩm bị ôi thiu do các phản ứng oxi hóa của oxygen cũng như sự hoạt động của vi khuẩn...
Câu hỏi 4 trang 92 Hóa học 10: Em có nhận xét gì nếu trong biểu thức (5), nồng độ của chất A và B đều bằng 1M?..
Câu hỏi 5 trang 92 Hóa học 10: Trong phản ứng (6), nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?...
Câu hỏi 6 trang 93 Hóa học 10: Khi nồng độ của H2(g) cũng như I2(g) đều tăng lên gấp đôi thì tốc độ phản ứng của H2(g) với I2(g) tăng lên mấy lần?...
Vận dụng 3 trang 93 Hóa học 10: Hãy giải thích các hiện tượng dưới đây. a) Khi ở nơi đông người trong không gian kín, ta cảm thấp khó thở và phải thở nhanh hơn...
Thực hành trang 94 Hóa học 10: Chuẩn bị hai mẩu đá vôi nhỏ A và B có khối lượng xấp xỉ bằng nhau. Tán nhỏ mẩu đá vôi B thành bột..
Câu hỏi 7 trang 94 Hóa học 10: Quan sát hình 16.4, giải thích vì sao khi dùng đá vôi dạng bột thì tốc độ phản ứng nhanh hơn...
Vận dụng 4 trang 94 Hóa học 10: Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn...
Thực hành trang 95 Hóa học 10: Cho hai đinh sắt tương tự nhau (tẩy sạch gỉ và dầu mỡ) vào hai ống nghiệm chứa cùng một thể tích dung dịch HCl 1M...
Câu hỏi 8 trang 95 Hóa học 10: Vì sao đinh sắt trong thí nghiệm bên phải được tẩy sạch gỉ và dầu mỡ?...
Câu hỏi 9 trang 95 Hóa học 10: Dựa vào hiện tượng nào để so sánh tốc độ phản ứng trong hai thí nghiệm này?...
Câu hỏi 10 trang 95 Hóa học 10: Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng bao nhiêu lần?...
Thực hành trang 96 Hóa học 10: Rót khoảng 2 ml nước oxi già (dung dịch H2O2 3%) vào một ống nghiệm. Quan sát hiện tượng xảy ra. Tiếp theo thêm một lượng nhỏ bột MnO2...
Vận dụng 5 trang 97 Hóa học 10: Enzyme amylase và lipase có trong nước bọt. Hãy giải thích vì sao chúng ta cần phải nhai kĩ thức ăn trước khi nuốt...
Bài 1 trang 98 Hóa học 10: Nồi áp suất dùng để ninh, hầm thức ăn có thể làm nóng nước tới nhiệt độ 120oC so với 100oC khi dùng nồi thường...
Bài 2 trang 98 Hóa học 10: Hình ảnh bên minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng? Giải thích...
Bài 3 trang 98 Hóa học 10: Khí H2 có thể được điều chế bằng cách cho miếng sắt vào dung dịch HCl. Hãy đề xuất các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2 từ cách này...
Bài 4 trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau...
Bài 5 trang 98 Hóa học 10: Phản ứng A →sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0; t = 1 phút; t = 2 phút lần lượt là 0,1563 M; 0,1496 M; 0,1431 M...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
Bài 17: Nguyên tố đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid
Bài 1: Nhập môn Hoá học
Bài 2: Các thành phần của nguyên tử

