Với giải Câu hỏi trang 72 SBT Hoá học10 Kết nối tri thức Bài 23: On tập chương 7 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập SBT Hoá học 10. Mời các bạn đón xem:
SBT Hoá học 10 Kết nối tri thức trang 72 Bài 23: Ôn tập chương 7
Bài 23.6 trang 72 SBT Hóa học 10: Trong dãy hydrogen halide, từ HF đến HI, độ dài liên kết biến đổi như thế nào?
A. Không đổi.
B. Giảm dần.
C. Tăng dần.
D. Tuần hoàn.
Phương pháp giải:
Dựa vào bán kính nguyên tử của nhóm halogen tăng dần từ fluorine đến iodine → khoảng cách giữa nguyên tử H và nguyên tử halogen tăng dần
Lời giải:
- Đáp án: C
Bài 23.7 trang 72 SBT Hóa học 10: Dung dịch hydrohalic acid có khả năng ăn mòn thuỷ tinh là
A. HCl.
B. HI.
C. HF.
D. HBr.
Lời giải:
- Đáp án: C
- Cụ thể: SiO2 + 4HF → SiF4 + 2H2O
Bài 23.8 trang 72 SBT Hóa học 10: Trong phòng thí nghiệm, có thể điều chế khí Cl2 khi cho chất rắn nào sau đây tác dụng với dung dịch HCl đặc, đun nóng?
A. CaCO3.
B. NaHCO3.
C. FeO.
D. MnO2.
Phương pháp giải:
Trong phòng thí nghiệm, người ta sử dụng các chất có tính oxi hóa mạnh (MnO2, KMnO4,…) tác dụng với HCl để điều chế khí Cl2
Lời giải:
- Đáp án: D
- Cụ thể: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Bài 23.9 trang 72 SBT Hóa học 10: Cho khí Cl2 tác dụng với dung dịch KOH, đun nóng, thu được dung dịch chứa muối KCl và muối nào sau đây?
A. KClO.
B. KClO3.
C. KClO4.
D. KClO2.
Lời giải:
- Đáp án: B
- Cụ thể: 3Cl2 + 6KOH -> 5KCl + KClO3 + 3H2O
Bài 23.10 trang 72 SBT Hóa học 10: Hydrohalic acid nào sau đây có tính acid mạnh nhất?
A. HI.
B. HF.
C. HCl.
D. HBr.
Phương pháp giải:
Dựa vào bán kính nguyên tử của nhóm halogen tăng dần từ fluorine đến iodine → khoảng cách giữa nguyên tử H và nguyên tử halogen tăng dần → nguyên tử H có độ linh động tăng dần → tính acid càng mạnh
Lời giải:
- Đáp án: A
Bài 23.11 trang 72 SBT Hóa học 10: Quặng apatite, loại quặng phổ biến trong tự nhiên có chứa nguyên tố fluorine, có thành phần hoá học chính là
A. CF3Cl.
B. NaF.
C. Na3AlF6.
D. Ca10(PO4)6F2.
Lời giải:
- Đáp án: D
Bài 23.12 trang 72 SBT Hóa học 10: Ở nhiệt độ cao và có xúc tác, phản ứng giữa hydrogen với halogen nào sau đây xảy ra thuận nghịch?
A. F2.
B. I2.
C. Br2.
D. Cl2.
Lời giải:
- Đáp án: B
- Cụ thể:
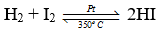
Bài 23.13 trang 72 SBT Hóa học 10: Trong các đơn chất halogen, từ F2 đến I2, nhiệt độ sôi biến đổi như thế nào?
A. Giảm dần.
B. Tuần hoàn.
C. Không đổi.
D. Tăng dần.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải:
- Đáp án: D
Bài 23.14 trang 72 SBT Hóa học 10: Ở cùng điều kiện, giữa các phân tử đơn chất halogen nào sau đây có tương tác van der Waals mạnh nhất?
A. I2.
B. Br2.
C. Cl2.
D. F2.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải:
- Đáp án: A
Bài 23.15 trang 72 SBT Hóa học 10: Khi phản ứng với phi kim, các nguyên tử halogen thể hiện xu hướng nào sau đây?
A. Nhường 1 electron.
B. Nhận 1 electron
C. Nhận 2 electron.
D. Góp chung electron.
Lời giải:
- Đáp án: D
- Giải thích: Đây là liên kết giữa các nguyên tử có cùng bản chất về mặt hóa học " Tạo liên kết cộng hóa trị → Các nguyên tố góp chung electron
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 23.1 trang 71 SBT Hóa học 10: Nguyên tử halogen nào sau đây chỉ thể hiện số oxi hoá -1 trong các hợp chất?...
Bài 23.2 trang 71 SBT Hóa học 10: Trong y học, halogen nào sau đây được hoà tan trong cồn để dùng làm thuốc sát trùng ngoài da?...
Bài 23.3 trang 71 SBT Hóa học 10: Trong tự nhiên, nguyên tố chlorine tồn tại phổ biến nhất ở dạng hợp chất nào sau đây?...
Bài 23.4 trang 71 SBT Hóa học 10: Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen có dạng chung là...
Bài 23.5 trang 71 SBT Hóa học 10: Ở điều kiện thường, halogen nào sau đây tồn tại ở thể lỏng, có màu nâu đỏ, gây bỏng sâu nếu rơi vào da?...
Bài 23.6 trang 72 SBT Hóa học 10: Trong dãy hydrogen halide, từ HF đến HI, độ dài liên kết biến đổi như thế nào?...
Bài 23.7 trang 72 SBT Hóa học 10: Dung dịch hydrohalic acid có khả năng ăn mòn thuỷ tinh là...
Bài 23.8 trang 72 SBT Hóa học 10: Trong phòng thí nghiệm, có thể điều chế khí Cl2 khi cho chất rắn nào sau đây tác dụng với dung dịch HCl đặc, đun nóng?...
Bài 23.9 trang 72 SBT Hóa học 10: Cho khí Cl2 tác dụng với dung dịch KOH, đun nóng, thu được dung dịch chứa muối KCl và muối nào sau đây?...
Bài 23.10 trang 72 SBT Hóa học 10: Hydrohalic acid nào sau đây có tính acid mạnh nhất?...
Bài 23.11 trang 72 SBT Hóa học 10: Quặng apatite, loại quặng phổ biến trong tự nhiên có chứa nguyên tố fluorine, có thành phần hoá học chính là...
Bài 23.12 trang 72 SBT Hóa học 10: Ở nhiệt độ cao và có xúc tác, phản ứng giữa hydrogen với halogen nào sau đây xảy ra thuận nghịch?...
Bài 23.13 trang 72 SBT Hóa học 10: Trong các đơn chất halogen, từ F2 đến I2, nhiệt độ sôi biến đổi như thế nào?...
Bài 23.14 trang 72 SBT Hóa học 10: Ở cùng điều kiện, giữa các phân tử đơn chất halogen nào sau đây có tương tác van der Waals mạnh nhất?...
Bài 23.15 trang 72 SBT Hóa học 10: Khi phản ứng với phi kim, các nguyên tử halogen thể hiện xu hướng nào sau đây?...
Bài 23.16 trang 73 SBT Hóa học 10: Chất nào sau đây có nhiệt độ sôi thấp nhất dưới áp suất thường?...
Bài 23.17 trang 73 SBT Hóa học 10: Dung dịch nào sau đây có thể phân biệt được hai dung dịch HCl và NaCl?...
Bài 23.18 trang 73 SBT Hóa học 10: Hai chất nào sau đây được cho vào muối ăn để bổ sung nguyên tố iodine?...
Bài 23.19 trang 73 SBT Hóa học 10: Không sử dụng chai lọ thuỷ tinh mà thường dùng chai nhựa để chứa, đựng, bảo quản hydrohalic acid nào sau đây?..
Bài 23.20 trang 73 SBT Hóa học 10: Cho các phát biểu sau...
Bài 23.21 trang 73 SBT Hóa học 10: Hydrochloric acid được dùng để đánh sạch lớp gỉ đồng màu xanh gồm hydroxide và muối carbonate...
Bài 23.22 trang 73 SBT Hóa học 10: Cho các dung dịch hydrofluoric acid, potassium iodide, sodium chloride, kí hiệu ngẫu nhiên là X, Y, Z...
Bài 23.23 trang 74 SBT Hóa học 10: Cho từ từ đến hết 10 g dung dịch X gồm NaF 0,84% và NaCl 1,17%, vào dung dịch AgNO3 dư, thu được m g kết tủa....
Bài 23.24 trang 74 SBT Hóa học 10: Trong công nghiệp, nước Javel được sản xuất bằng phương pháp điện phân dung dịch NaCl...
![]()