Toptailieu.vn xin giới thiệu sơ lược Lý thuyết Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (Lý thuyết + 35 bài tập có lời giải) Hóa học 11 chọn lọc, hay nhất giúp học sinh lớp 11 ôn luyện để nắm chắc kiến thức cơ bản và đạt kết quả cao trong các bài thi môn Hóa học.
Nội dung bài viết
Mời các bạn đón xem:
Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (Lý thuyết + 35 bài tập có lời giải)
A. Lý thuyết Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Axit, bazơ và muối
I. Axit
- Theo thuyết A-rê-ni-ut, axit là chất khi tan trong nước phân li ra cation H+.
Thí dụ:
HCl→H+
Chú ý: Các dung dịch axit đều có một số tính chất chung, đó là tính chất của các cation H+ có trong dung dịch.
- Axit 1 nấc là các axit khi tan trong nước mà phân tử chỉ phân li một nấc ra ion H+.
Thí dụ: HCl, HBr, HNO3…
- Axit nhiều nấc là axit khi tan trong nước mà phân tử phân li nhiều nấc ra ion H+.
Thí dụ:
⇒ H3PO4 là axit ba nấc.
II. Bazơ
- Theo thuyết A-rê-ni-ut, bazơ là chất khi tan trong nước phân li ra anion .
Thí dụ:
- Chú ý: Các dung dịch bazơ đều có một số tính chất chung, đó là tính chất của các anion OH- trong dung dịch.
III. Hiđroxit lưỡng tính
- Hiđroxit lưỡng tính là những hiđroxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
- Các hiđroxit lưỡng tính thường gặp: Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3…
Ví dụ:
Phân li theo kiểu bazơ:
Phân li theo kiểu axit:
IV. Muối
1. Định nghĩa và phân loại
- Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc cation ) và anion gốc axit.
- Muối được chia làm hai loại chính: muối axit, muối trung hoà.
+ Muối axit: Muối có anion gốc axit còn hiđro có khả năng phân li cho ion H+.
Ví dụ: NaHCO3; NaH2PO4; NaHSO4; ...
+ Muối trung hoà: Muối có anion gốc axit không còn hiđro có khả năng phân li cho ion H+.
Ví dụ: NaCl , (NH4)2SO4, Na2CO3, ...
Chú ý: Trong gốc axit của một số muối như Na2HPO3, NaH2PO2 vẫn còn H, nhưng các muối đó là muối trung hòa, vì các hiđro đó không có tính axit.
2. Sự điện li của muối trong nước
- Hầu hết các muối khi tan trong nước phân li hoàn toàn thành cation kim loại (hoặc cation) và anion gốc axit.
Thí dụ:
Gốc có khả năng tiếp tục phân li ra ion H+.
Phản ứng trao đổi ion trong dung dịch các chất điện li
1. Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓

Kết tủa BaSO4
+ Phản ứng tạo thành chất điện li yếu:
HCl + NaOH → NaCl + H2O
+ Phản ứng tạo thành chất khí:
Fe + H2SO4 loãng → FeSO4 + H2↑
2. Phương trình ion rút gọn
- Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Cách chuyển từ phương trình dưới dạng phân tử thành phương trình ion rút gọn như sau:
Bước 1:
+ Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion.
+ Các chất khí, chất kết tủa, chất điện li yếu để nguyên ở dạng phân tử.
⇒ Khi này, phương trình thu được gọi là phương trình ion đầy đủ.
Thí dụ: Xét phản ứng:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
Phương trình ion đầy đủ là:
2Na+ ++ Ba2+ + 2Cl- → BaSO4↓ + 2Na+ + 2Cl-
Bước 2: Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn.
Ba2+ +→ BaSO4↓
Từ phương trình này ta thấy rằng, muốn điều chế kết tủa BaSO4 chỉ cần trộn 2 dung dịch, một dung dịch chứa Ba2+, dung dịch kia chứa ion SO42-.
B. Bài tập Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu 1: Chất nào sau đây là chất điện li mạnh?
A.
B.
C.
D.
Đáp án: D
Câu 2: Trong các dãy chất sau, dãy nào đều gồm các chất điện li mạnh?
A. NaCl, HCl, NaOH
B. HF, C6H6, KCl
C. H2S, H2SO4, NaOH
D. H2S, CaSO4, NaHCO3
Đáp án: A
Câu 3: Chất nào sau đây là muối trung hòa?
A. NaOH.
B. NaHCO3.
C. Na2SO4.
D. NaHSO4.
Đáp án: C
Câu 4: Chất nào sau đây có tính lưỡng tính?
A. AlCl3.
B. Fe(OH)2.
C. HCl.
D. Al(OH)3.
Đáp án: D
Câu 5: Chất nào sau đây là muối axit?
A. NaCl
B. NaH2PO4.
C. NaOH.
D. NaNO3.
Đáp án: B
Câu 6: Chất nào sau đây là chất điện li mạnh?
A.
B.
C.
D. NaOH
Đáp án: D
Câu 7: Chất nào sau đây không phải chất điện li trong nước?
A.
B. (fructozơ).
C. NaOH.
D. HCl.
Đáp án: B
Câu 8: Dãy gồm các ion cùng tồn tại trong một dung dịch là
A.
B.
C.
D.
Đáp án: D
Câu 9: Chất nào sau đây là chất điện li yếu?
A. KOH
B. HNO3
C. CH3COOH
D. NH4Cl
Đáp án: C
Câu 10: Chất nào sau đây là chất điện li?
A. KCl
B. CH3CHO
C. Cu
D. C6H12O6 (glucozơ)
Đáp án: A
Câu 11: Một dung dịch X gồm 0,01 mol Na+; 0,02 mol Ca2+; 0,02 mol và a mol Y (bỏ qua sự điện li của nước). Ion Y và giá trị của a là
A. OH- và 0,03.
B. Cl- và 0,01.
C. và 0,03.
D. và 0,03.
Đáp án: D
Câu 12: Chất nào dưới đây không phải là chất điện li?
A. C2H5OH.
B. NaHCO3.
C. KOH.
D. H2SO4.
Đáp án: A
Câu 13: Trong các dãy chất sau, dãy nào đều gồm các chất điện li mạnh
A. NaClO4, HCl, NaOH
B. HF, C6H6, KCl.
C. H2S, H2SO4, NaOH
D. H2S, CaSO4, NaHCO3.
Đáp án: A
Câu 14: Dãy gồm các ion (không kể đến sự phân li của nước) cùng tồn tại trong một dung dịch là:
A.
B.
C.
D.
Đáp án: C
Câu 15: Cho các phương trình sau :
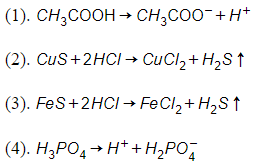
Số phương trình được viết đúng là :
A. 1
B. 2
C. 3
D. 4.
Đáp án: A
Câu 16: Dung dịch X có 0,1 mol K+; 0,2 mol Mg2+; 0,1 mol Na+; 0,2 mol và a mol . Ion và giá trị của a là
A. và 0,4.
B. OH- và 0,2.
C. OH- và 0,4.
D. và 0,2.
Đáp án: A
Câu 17: Dãy gồm các ion nào sau đây không tồn tại trong cùng một dung dịch?
A.
B.
C.
D.
Đáp án: D
Câu 18: Dãy các ion cùng tồn tại trong một dung dịch là
A.
B.
C.
D.
Đáp án: B
Câu 19: HCOOH là một axit yếu. Độ điện li của axit này sẽ biến đổi như thế nào khi nhỏ vào dung dịch HCOOH vài giọt dung dịch HCl (coi V không thay đổi )?
A. tăng
B. giảm
C. không biến đổi
D. không xác định được.
Đáp án: B
Câu 20: Khi cho 100 ml dung dịch KOH 1M vào 100 ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 0,75M.
B. 1M.
C. 0,25M.
D. 0,5M.
Đáp án: D
Câu 21: Ion không tác dụng với tất cả các ion thuộc dãy nào sau đây ?
A.
B.
C.
D.
Đáp án: A
Câu 22: Trộn 100 ml dung dịch HCl có pH = 1 với 100 ml dung dịch gồm KOH 0,1M và NaOH aM, thu được 200 ml dung dịch có pH = 12. Giá trị của a là
A. 0,12
B. 0,08.
C. 0,02.
D. 0,10.
Đáp án: C
Câu 23: Cho khoảng 2 ml dung dịch Na2CO3 đặc vào ống nghiệm đựng khoảng 2 ml dung dịch CaCl2. Hiện tượng xảy ra là
A. xuất hiện kết tủa vàng
B. xuất hiện kết tủa trắng.
C. xuất hiện bọt khí không mầu.
D. xuất hiện bọt khí màu nâu đỏ.
Đáp án: B
Câu 24: Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7.
B. 2.
C. 1.
D. 6.
Đáp án: B
Câu 25: Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tuả là
A. 6.
B. 5.
C. 7.
D. 4.
Đáp án: A
Câu 26: Cho các chất sau đây: H2O, HCl, NaOH, NaCl, CH3COOH, CuSO4. Các chất điện li yếu là
A. H2O, CH3COOH, CuSO4
B. CH3COOH, CuSO4
C. H2O, CH3COOH
D. H2O, NaCl, CH3COOH , CuSO4
Đáp án: C
Câu 27: Hòa tan CaCO3 bằng dung dịch HCl loãng. Hiện tượng xảy ra là
A. chỉ thu được dung dịch trong suốt không màu.
B. chỉ thu được dung dịch trong suốt màu xanh lam.
C. xuất hiện bọt khí không màu.
D. xuất hiện bọt khí màu lục.
Đáp án: C
Câu 28: Đặt ba mẩu giấy quỳ tím lên mặt kính. Lần lượt nhỏ lên mỗi mẩu giấy đó một giọt dung dịch tương ứng: CH3COOH 0,10M; NH3 0,10M và NaOH 0,10M. Màu sắc của ba mẩu giấy quỳ tím sau khi nhỏ dung dịch lần lượt là
A. đỏ, hồng, xanh nhạt.
B. hồng, xanh đậm, xanh nhạt.
C. hồng, xanh nhạt, xanh đậm.
D. xanh đậm, xanh nhạt và hồng.
Đáp án: C
Câu 29: Dung dịch A có a mol NH , b mol Mg2+, c mol và d mol . Biểu thức nào dưới đây biểu thị đúng sự liên quan giữa a, b, c, d ?
A. a + 2b = c + d
B. a + 2b = 2c + d
C. a + b = 2c + d
D. a + b = c + d
Đáp án: B
Câu 30: Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch có pH = 4?
A. 5.
B. 100.
C. 20.
D. 10.
Đáp án: D
Câu 31: Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 6,72 lít khí (đktc) và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 69,4.
D. 64,0.
Đáp án: A
Câu 32: Cho 47 gam K2O vào m gam dung dịch KOH 14%, thu được dung dịch KOH 21%. Giá trị của m là
A. 353.
B. 659.
C. 753.
D. 800.
Đáp án: B
Câu 33: Để pha được 1 lít dung dịch chứa Na2SO4 0,04M, K2SO4 0,05 M và KNO3 0,08M cần lấy
A. 12,15 gam K2SO4 và 10,2 gam NaNO3.
B. 8,08 gam KNO3 và 12,78 gam Na2SO4.
C. 15,66 gam K2SO4 và 6,8 gam NaNO3.
D. 9,09 gam KNO3 và 5,68 gam Na2SO4.
Đáp án: C
Câu 34: Hòa tan một hỗn hợp 7,2 gam gồm hai muối sunfat của kim loại A và B vào nước được dung dịch X. Thêm vào dung dịch X môt lượng vừa đủ BaCl2 đã kết tủa ion SO42-, thu được 11,65 gam BaSO4 và dung dịch Y. Tổng khối lượng hai muối clorua trong dung dịch Y là
A. 5,95 gam.
B. 6,5 gam.
C. 7,0 gam.
D. 8,2 gam.
Đáp án: A
Câu 35: Cho 1 lít dung dịch gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng với 43 gam hỗn hợp rắn Y gồm BaCl2 và CaCl2. Sau khi phản ứng kết thúc, thu được 39,7 gam kết tủa. Tỉ lệ khối lượng của BaCl2 trong Y là
A. 24,19%.
B. 51,63%.
C. 75,81%.
D. 48,37%
Đáp án: D
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.