Toptailieu.vn xin giới thiệu sơ lược Lý thuyết Phản ứng trao đổi ion trong dung dịch các chất điện li (Lý thuyết + 35 bài tập có lời giải)Hóa học11 chọn lọc, hay nhất giúp học sinh lớp 11ôn luyện để nắm chắc kiến thức cơ bản và đạt kết quả cao trong các bài thi môn Hóa học.
Nội dung bài viết
Mời các bạn đón xem:
Phản ứng trao đổi ion trong dung dịch các chất điện li (Lý thuyết + 35 bài tập có lời giải)
A. Lý thuyết Phản ứng trao đổi ion trong dung dịch các chất điện li
1. Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓

Kết tủa BaSO4
+ Phản ứng tạo thành chất điện li yếu:
HCl + NaOH → NaCl + H2O
+ Phản ứng tạo thành chất khí:
Fe + H2SO4 loãng → FeSO4 + H2↑
2. Phương trình ion rút gọn
- Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Cách chuyển từ phương trình dưới dạng phân tử thành phương trình ion rút gọn như sau:
Bước 1:
+ Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion.
+ Các chất khí, chất kết tủa, chất điện li yếu để nguyên ở dạng phân tử.
⇒ Khi này, phương trình thu được gọi là phương trình ion đầy đủ.
Thí dụ: Xét phản ứng:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
Phương trình ion đầy đủ là:
2Na+ +SO42-+ Ba2+ + 2Cl- → BaSO4↓ + 2Na+ + 2Cl-
Bước 2: Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn.
Ba2+ +SO42-→ BaSO4↓
Từ phương trình này ta thấy rằng, muốn điều chế kết tủa BaSO4 chỉ cần trộn 2 dung dịch, một dung dịch chứa Ba2+, dung dịch kia chứa ion SO42-.
B. Bài tập Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu 1: Dãy ion không thể tồn tại đồng thời trong dung dịch là
A. Na+, OH−, Mg2+, NO−3
B. K+, H+, Cl−, SO2−4
C. HSO−3, Mg+, Ca2+, NO−3
D. OH−, Na+, Ba2+, Cl−
Đáp án: A
Câu 2: Phương trình phản ứng: Ba(OH)2 + 2HCl → BaCl2 + 2H2O có phương trình ion rút gọn là:
A. H+ + OH– → H2O
B. Ba2+ + 2OH– + 2H+ + 2Cl– → BaCl2 + 2H2O
C. Ba2+ + 2Cl– → BaCl2
D. Cl– + H+ → HCl
Đáp án: A
Câu 3: Cho phản ứng: Mg(OH)2 + 2HCl → MgCl2 + H2O.
Phương trình ion thu gọn của phản ứng trên là
A. HCl + OH – → H2O + Cl−.
B. 2H+ + Mg(OH)2 → Mg2+ + 2H2O.
C. H+ + OH – → H2O.
D. 2HCl + Mg(OH)2 → Mg2+ + 2Cl− + 2H2O.
Đáp án: B
Câu 4: Phương trình ion rút gọn Ba2+ + SO2−4 → BaSO4 tương ứng với phương trình phân tử nào sau đây?
A. Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2.
B. H2SO4 + BaCO3 → BaSO4 + CO2 + H2O.
C. Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3.
D. H2SO4 + Ba(OH)2 → BaSO4 + 2H2O.
Đáp án: C
Câu 5: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch các chất điện li?
A. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
B. 2HCl + FeS → FeCl2 + H2S
C. NaOH + HCl → NaCl + H2O
D. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Đáp án: C
Câu 6: Trong dung dịch, ion OH- không tác dụng được với ion
A. K+.
B. H+.
C. HCO−3
D. Fe3+.
Đáp án: A
Câu 7: Cho dung dịch X chứa các ion: H+, Ba2+, NO−3 vào dung dịch Y chứa các ion: Na+, SO2−3, SO2−4, S2−. Số phản ứng xảy ra là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: D
Câu 8: Cho các phản ứng hóa học sau:
(1) NaHS + NaOH →
(2) Ba(HS)2 + KOH →
(3) Na2S + HCl →
(4) CuSO4 + Na2S →
(5) FeS + HCl →
(6) NH4HS + NaOH →
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (3), (4), (5).
B. (1), (2).
C. (1), (2), (6).
D. (1), (6).
Đáp án: B
Câu 9: Phương trình ion thu gọn: Ca2++CO2−3→CaCO3↓ là của phản ứng xảy ra giữa cặp chất nào sau đây?
(1) CaCl2 + Na2CO3
(2) Ca(OH)2 + CO2
(3) Ca(HCO3)2 + NaOH
(4) Ca(NO3)2 + (NH4)2CO3
A. (1) và (2).
B. (2) và (3).
C. (1) và (4).
D. (2) và (4).
Đáp án: C
Câu 10: Phản ứng nào dưới đây là phản ứng trao đổi ion trong dung dịch?
A. Zn + H2SO4 ZnSO4 + H2
B. Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3
C. 2Fe(NO3)3 + 2KI 2Fe(NO3)2 + I2 + 2KNO3
D. Zn + 2Fe(NO3)3 Zn(NO3)2 + 2Fe(NO3)2
Đáp án: B
Câu 11: Phương trình H++OH−→H2O là phương trình ion thu gọn của phản ứng có phương trình sau:
A. NaOH + NaHCO3 → Na2CO3 + H2O
B. NaOH + HCl → NaCl + H2O
C. H2SO4 + BaCl2 → BaSO4 + 2HCl
D. 3HCl + Fe(OH)3 → FeCl3 + 3H2O
Đáp án: B
Câu 12: Cho phương trình phản ứng: KOH + HCl → KCl + H2O. Phương trình ion rút gọn của phản ứng trên là
A. H++OH−→H2O
B. K++Cl−→KCl
C. 2H++OH−→H2O
D. H++2OH−→H2O
Đáp án: A
Câu 13: Dãy ion nào sau đây có thể tồn tại trong cùng một dung dịch?
A. Na+, Cl- , S2-, Cu2+.
B. K+,OH- , Ba2+, HCO−3.
C.NH+4 , Ba2+, NO−3,OH- .
D. HSO−4,NH+4 , Na+, NO−3.
Đáp án: D
Câu 14: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi:
A. các chất phản ứng phải là những chất dễ tan.
B. các chất phản ứng phải là những chất điện li mạnh.
C. một số ion trong dung dịch kết hợp được với nhau tạo thành chất kết tủa hoặc chất khí hoặc chất điện li yếu.
D. phản ứng không phải là thuận nghịch.
Đáp án: C
Câu 15: Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 6,72 lít khí (đktc) và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 69,4.
D. 64,0.
Đáp án: A
Câu 16: Cho 1 lít dung dịch X gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng với 43 gam hỗn hợp rắn Y gồm BaCl2 và CaCl2. Sau khi phản ứng kết thúc, thu được 39,7 gam kết tủa. Tỉ lệ khối lượng của BaCl2 trong Y là
A. 24,19%.
B. 51,63%.
C. 75,81%.
D. 48,37%
Đáp án: D
Câu 17: Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án: C
Câu 18: Dung dịch X có chứa 0,07 mol Na+; 0,02 mol SO2−4 và x mol OH-. Dung dịch Y có chứa ClO−4, NO−3 và y mol H+; tổng số mol ClO−4, NO−3 là 0,04 mol. Trộn X và T được 100 ml dung dịch Z. Dung dịch Z có pH (bỏ qua sự điện li của H2O) là :
A. 1.
B. 12.
C. 13.
D. 2.
Đáp án: A
Câu 19: Cho 47 gam K2O vào m gam dung dịch KOH 14%, thu được dung dịch KOH 21%. Giá trị của m là
A. 353.
B. 659.
C. 753.
D. 800.
Đáp án: B
Câu 20: Dung dịch X chứa 0,2 mol Ca2+; 0,15 mol Mg2+; 0,4 mol và a mol . Đun dung dịch X đến cạn thu được muối khan có khối lượng là
A. 43,8 gam
B. 44,1 gam
C. 34,8 gam
D. 25,5 gam
Đáp án: C
Câu 21: Hãy chọn câu trả lời đúng: Phản ứng trao đổi trong dung dịch các chất điện li chỉ có thể xảy ra khi có ít nhất một trong các điều kiện sau:
A. tạo thành chất kết tủa.
B. tạo thành chất khí
C. tạo thành chất điện li yếu.
D. hoặc A, hoặc B, hoặc C.
Đáp án: D
Câu 22: Dung dịch X chứa hỗn hợp cùng số mol CO2−3và . Cho dung dịch X tác dụng với dung dịch BaCl2 dư thu được 43 gam kết tủa. Số mol mỗi ion có trong dung dịch X là
A. 0,05
B. 0,1
C. 0,15
D. 0,20
Đáp án: B
Câu 23: Dung dịch X chứa các ion: Fe3+, SO2−4, NH+4, Cl−. Chia dung dịch X thành hai phần bằng nhau:
- Phần một tác dụng với lượng dư dung dịch NaOH, đun nóng thu được 0,672 lít khí (đktc) và 1,07 gam kết tủa.
- Phần hai cho tác dụng với lượng dư dung dịch BaCl2, thu được 4,66 gam kết tủa.
Tổng khối lượng (gam) các muối khan thu được khi cô cạn dung dịch X là
A. 3,52
B. 3,73
C. 7,04
D. 7,46
Đáp án: D
Câu 24: Cho dung dịch NaOH có dư tác dụng với dung dịch Ba(HCO3)2. Tìm phương trình ion rút gọn của phản ứng này.
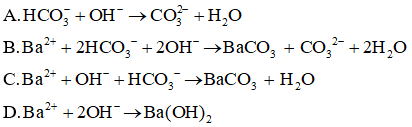
Đáp án: B
Câu 25: Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m(g) kết tủa. Giá trị của m là
A. 39,4.
B. 17,1.
C. 15,5.
D. 19,7.
Đáp án: D
Câu 26: Phương trình phân tử nào sau đây, có phương trình ion rút gọn là
CO2−3+2H+→CO2↑+H2O
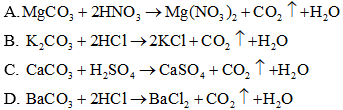
Đáp án: B
Câu 27: Trộn 40 ml dung dịch H2SO4 0,25M với 60ml dung dịch NaOH 0,5M. Giá trị pH của dung dịch thu được sau khi trộn là
A. pH=14.
B. pH=13.
C. pH=12.
D. pH= 9.
Đáp án: B
Câu 28: Một trong các nguyên nhân gây bệnh đau dạ dày là do lượng axit trong dạ dày quá cao. Để giảm bớt lượng axit, người ta thường uống dược phẩm Nabica (NaHCO3). Phương trình ion rút gọn của phản ứng xảy ra là
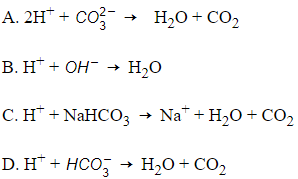
Đáp án: D
Câu 29: Trong dãy các ion sau dãy nào chứa các ion đều phản ứng được với
A. NH+4, HCO−3, CO2−3
B. Mg2+, HSO−3, SO2−3
C. H+, Ba2+, Al3+
D. Fe3+, HPO2−4, HS−
Đáp án: D
Câu 30: Cho dung dịch Ba(OH)2 dư vào dung dịch đồng thời chứa các ion: NH+4, HCO−3, SO2−4, K+. Số phản ứng dạng ion thu gọn xảy ra là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: C
Bài 31: Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 6,72 lít khí (đktc) và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 69,4.
D. 64,0.
Đáp án: A
Bài 32: Cho 47 gam K2O vào m gam dung dịch KOH 14%, thu được dung dịch KOH 21%. Giá trị của m là
A. 353.
B. 659.
C. 753.
D. 800.
Đáp án: B
Bài 33: Để pha được 1 lít dung dịch chứa Na2SO4 0,04M, K2SO4 0,05 M và KNO3 0,08M cần lấy
A. 12,15 gam K2SO4 và 10,2 gam NaNO3.
B. 8,08 gam KNO3 và 12,78 gam Na2SO4.
C. 15,66 gam K2SO4 và 6,8 gam NaNO3.
D. 9,09 gam KNO3 và 5,68 gam Na2SO4.
Đáp án: C
Bài 34: Hòa tan một hỗn hợp 7,2 gam gồm hai muối sunfat của kim loại A và B vào nước được dung dịch X. Thêm vào dung dịch X môt lượng vừa đủ BaCl2 đã kết tủa ion SO42-, thu được 11,65 gam BaSO4 và dung dịch Y. Tổng khối lượng hai muối clorua trong dung dịch Y là
A. 5,95 gam.
B. 6,5 gam.
C. 7,0 gam.
D. 8,2 gam.
Đáp án: A
Bài 35: Cho 1 lít dung dịch gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng với 43 gam hỗn hợp rắn Y gồm BaCl2 và CaCl2. Sau khi phản ứng kết thúc, thu được 39,7 gam kết tủa. Tỉ lệ khối lượng của BaCl2 trong Y là
A. 24,19%.
B. 51,63%.
C. 75,81%.
D. 48,37%
Đáp án: D
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.