Toptailieu.vn xin giới thiệu sơ lược Lý thuyết Sự điện li của nước. pH. Chất chỉ thị axit-bazơ (Lý thuyết + 35 bài tập có lời giải) Hóa học 11 chọn lọc, hay nhất giúp học sinh lớp 11 ôn luyện để nắm chắc kiến thức cơ bản và đạt kết quả cao trong các bài thi môn Hóa học.
Nội dung bài viết
Mời các bạn đón xem:
Sự điện li của nước. pH. Chất chỉ thị axit-bazơ (Lý thuyết + 35 bài tập có lời giải)
A. Lý thuyết Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
I. Nước là chất điện li rất yếu
1. Sự điện li của nước
- Nước là chất điện li rất yếu. Thực nghiệm đã xác định được ở nhiệt độ thường cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li ra ion.
- Phương trình điện li:
H2O⇄H++OH-
2. Tích số ion của nước
- Ở 25oC, tích số KH2O= [H+].[OH-] được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định. Tuy nhiên, giá trị tích số ion của nước thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều so với 25oC.
KH2O = [H+].[OH-] = 10-14
⇒ [H+] = [OH-] = 10-7 M.
- Môi trường trung tính là môi trường trong đó:
[H+] = [OH-] = 10-7 M.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
- Là môi trường trong đó
[H+] > [OH-] hay [H+] > 10-7 M.
b. Môi trường kiềm
- Là môi trường trong đó
[H+] < [OH-] hay [H+] < 10-7 M.
Kết luận: Độ axit và độ kiềm của dung dịch có thể đánh giá bằng nồng độ H+.
+ Môi trường trung tính: [H+] = 10-7 M.
+ Môi trường axit: [H+] > 10-7 M.
+ Môi trường kiềm: [H+] < 10-7 M.
II. Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH
- pH được dùng để đánh giá độ axit và độ kiềm của dung dịch.
- Quy ước: [H+]=1,0.10-pHM
Tức là: [H+]=1,0.10-aM thì pH = a.
Về mặt toán học:
- Thang pH thường dùng có giá trị từ 1 đến 14, trong đó:
+ pH < 7: môi trường axit.
+ pH > 7: môi trường bazơ.
+ pH = 7: môi trường trung tính.
- Giá trị của pH có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi hay tốc độ ăn mòn kim mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước.
2. Chất chỉ thị axit – bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
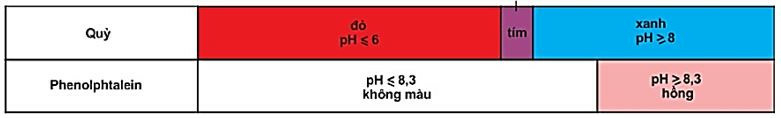
Ví dụ: Quỳ tím, phenolphatalenin.
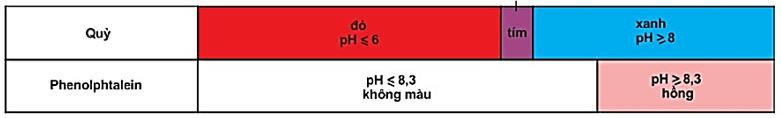
Hình 1: Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
- Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng.
Hình 2: Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
- Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
3. Bảng công thức pH trong các môi trường

Câu 1: Dung dịch X chứa HCl với nồng độ mol là 0,01M. pH của dung dịch là:
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: B
Câu 2: Dung dịch nào sau đây có pH bằng 7?
A. CH3COOH 1M
B. HCl 1M
C. NaOH 1M
D. KCL 1M
Đáp án: D
Câu 3: Cho các dung dịch có cùng nồng độ: Na2CO3 (1), H2SO4 (2), HCl (3), KNO3 (4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là:
A. (3), (2), (4), (1).
B. (4), (1), (2), (3).
C. (1), (2), (3), (4).
D. (2), (3), (4), (1).
Đáp án: D
Câu 4: Chọn câu trả lời sai :
A. Dung dịch pH = 7 có môi trường trung tính.
B. Dung dịch pH < 7 làm quỳ tím hóa đỏ.
C. Giá trị pH tăng thì độ axit tăng.
D. Giá trị [H+] tăng thì độ axit tăng.
Đáp án: C
Câu 5: Axit mạnh HNO3 và axit yếu HNO2 có cùng nồng độ mol 0,1M và ở cùng nhiệt độ. Sự so sánh nồng độ mol ion nào sau đây là đúng?
A. [H+] của HNO3 < [ H+] của HNO2.
B. [H+] của HNO3 > [H+] của HNO2.
C. [H+] của HNO3 = [H+] của HNO2.
D. [H+] của HNO3 < [H+] của HNO2.
Đáp án: B
Câu 6: Một dung dịch có [ OH−] =4,2.10−3 M, đánh giá nào dưới đây là đúng?
A. pH = 3.
B. pH = 4.
C. pH < 3.
D. pH > 4.
Đáp án: D
Câu 7: Cho a lít dung dịch KOH có pH = 12 vào 8 lít dung dịch HCl có pH = 3 thu được dung dịch Y có pH = 11. Giá trị của a là:
A. 0,12.
B. 1,6.
C. 1,78.
D. 0,8.
Đáp án: C
Câu 8: Dung dịch axit mạnh H2SO4 0,1M có:
A. pH = 1.
B. pH > 1.
C. pH < 1.
D. [H+] > 0,2M.
Đáp án: C
Câu 9: Dung dịch X gồm NaOH 0,1M và Ba(OH)2 0,2M. Thể tích dung dịch H2SO4 0,5M cần dùng để trung hòa hết 100 ml dung dịch X là:
A. 50 ml.
B. 100 ml.
C. 150 ml.
D. 200 ml.
Đáp án: A
Câu 10: Một dung dịch có pH = 5, đánh giá nào dưới đây là đúng?
A. [H+] = 2.10-5M.
B. [H+] = 5.10-4M.
C. [H+] = 10-5M.
D. [H+] = 10-4M.
Đáp án: C
Câu 11: Lấy 500 ml dung dịch chứa đồng thời HCl 1,98M và H2SO4 1,1M trộn với V lít dung dịch chứa NaOH 3M và Ba(OH)2 4M thì trung hòa vừa đủ. Giá trị của V là:
A. 0,14.
B. 0,17.
C. 0,18.
D. 0,19.
Đáp án: D
Câu 12: Dung dịch HCl có pH = 3. Cần pha loãng dung dịch axit này (bằng nước) bao nhiêu lần để thu được dung dịch HCl có pH = 4?
A. 9.
B. 10.
C. 99.
D. 100.
Đáp án: B
Câu 13: Một mẫu nước mưa có pH = 4,82. Vậy nồng độ H+ trong đó là:
A. 10-4M.
B. 10-5M.
C. > 10-5M.
D. < 10-5M.
Đáp án: C
Câu 14: Trộn 100ml H2SO4 0,2M với 400ml HCl 0,05M. Giá trị pH của dung dịch thu được là
A. 0,75.
B. 0,82.
C. 0,92.
D. 1,05.
Đáp án: C
Câu 15: Dung dịch NaOH có pH = 12. Cần pha loãng dung dịch này bao nhiêu lần để thu được dung dịch NaOH mới có pH = 11?
A. 10.
B. 100.
C. 1000.
D. 10000.
Đáp án: A
Câu 16: Trộn 200 ml Ba(OH)2 0,01M với 200 ml KOH 0,03M thu được dung dịch X. Giá trị pH của dung dịch X là
A. 9.
B. 10.
C. 12,4.
D. 13,2.
Đáp án: C
Câu 17: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: B
Câu 18: Pha loãng dung dịch HCl có pH = 2 bao nhiêu lần để được dung dịch có pH = 4?
A. 5.
B. 100.
C. 20.
D. 10.
Đáp án: B
Câu 19: Cho dung dịch X có pH = 2 chứa HCl và HNO3. Thể tích dung dịch KOH 0,1M cần để trung hòa 10 ml dung dịch X là:
A. 0,5 ml.
B. 1 ml.
C. 1,5 ml.
D. 2 ml.
Đáp án: B
Câu 20: Một dung dịch có [H+] = 1,5.10-4M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định được.
Đáp án: A
Câu 21: Đối với dung dịch axit mạnh HNO3 0,1M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,1M.
B. [H+] < [NO3-].
C. [H+] > [NO3-].
D. [H+] < 0,1M.
Đáp án: A
Câu 22: Pha loãng dung dịch KOH có pH = 13 bao nhiêu lần để được dung dịch có pH = 11?
A. 50.
B. 100.
C. 20.
D. 10.
Đáp án: B
Câu 23: Đối với dung dịch axit yếu CH3COOH 0,1M; nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,1M.
B. [H+] < [CH3COO-].
C. [H+] > [CH3COO-].
D. [H+] < 0,1M.
Đáp án: D
Câu 24: Trộn 150 ml dung dịch HCl 1M với 100 ml dung dịch gồm Ba(OH)2 0,4M và NaOH 0,6M. Nhúng giấy quỳ tím vào dung dịch sau phản ứng có hiện tượng:
A. quỳ tím chuyển sang màu đỏ.
B. quỳ tím chuyển sang màu xanh.
C. quỳ tím không đổi màu.
D. không xác định được màu quỳ tím.
Đáp án: A
Câu 25: Để trung hoà 100 gam dung dịch HCl 1,825% cần bao nhiêu ml dung dịch Ba(OH)2 có pH bằng 13?
A. 500 ml.
B. 0,5 ml.
C. 250 ml.
D. 50 ml.
Đáp án: A
Câu 26: Trộn 250 ml dung dịch chứa hỗn hợp HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch NaOH aM thu được 500 ml dung dịch có pH = 12. Giá trị a là
A. 0,13M.
B. 0,12M.
C. 0,14M.
D. 0,10M.
Đáp án: B
Câu 27: Cho các dung dịch HCl, H2SO4 và CH3COOH có cùng giá trị pH. Sự sắp xếp nào sau đây đúng với giá trị nồng độ mol của các dung dịch trên ?
A. HCl < H2SO4 < CH3COOH
B. H2SO4 < HCl < CH3COOH
C. H2SO4 < CH3COOH < HCl
D. CH3COOH < HCl < H2SO4
Đáp án: B
Câu 28: Nhỏ phenolphtalein vào dung dịch NaOH loãng. Nhỏ tiếp từ từ dung dịch HCl loãng dến dư. Hiện tượng xảy ra là
A. dung dịch từ màu xanh dần chuyển thành màu hồng.
B. dung dịch từ màu hồng dần chuyển thành màu xanh.
C. dung dịch từ màu xanh chuyển thàng không màu.
D. dung dịch từ màu hồng chuyển thành không màu.
Đáp án: D
Câu 29: Trộn hai dung dịch Ba(HCO3)2 và NaHSO4 có cùng nồng độ mol với nhau theo tỉ lệ thể tích 1 : 1 thu được kết tủa và dung dịch. Bỏ qua sự thủy phân của các ion và sự điện li của nước, các ion có mặt trong dung dịch Y là
A. Na+ và SO2−4
B. Ba2+, HCO−3 và Na+
C. Na+ và HCO−3
D. Na+, HCO−3 và SO2−4
Đáp án: C
Câu 30: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. NaCl.
B. NH4Cl.
C. Na2CO3.
D. FeCl3.
Đáp án: C
Bài 31: Chọn câu trả lời đúng, khi nói về muối axit :
A. Dung dịch muối có pH < 7.
B. Muối cố khả năng phản ứng với bazơ.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối mà gốc axit vẫn còn hiđro có khả năng phân li tạo proton trong nước.
Đáp án: D
Bài 32: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
A. 10 ml.
B. 15 ml.
C. 20 ml.
D. 25 ml.
Đáp án: C
Bài 33: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl- và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml.
B. 300 ml.
C. 200 ml.
D. 250 ml.
Đáp án: A
Bài 34: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330
B. 0,10 và 6,990.
C.0,10 và 4,660
D. 0.05 và 3,495
Đáp án: D
Bài 35: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
A. 134.
B. 147.
C. 114.
D. 169.
Đáp án: A
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.