Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng C6H5NH2 + Br2 → C6H2Br3NH2 + HBr. Đây là phương trình phản ứng trao đổi, khi cho Anilin tác dụng với Brom sản phẩm thu được tạo kết tủa trắng, phản ứng này các bạn hết lưu ý dùng để nhận biết anilin trong bài tập nhận biết. Mời các bạn đón đọc:
Nội dung bài viết
1. Phản ứng giữa C6H5NH2 và Br2
(↓ trắng)
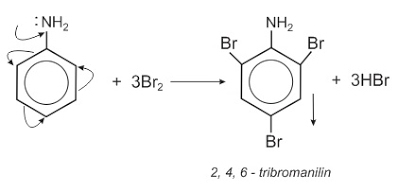
Do ảnh hưởng của nhóm NH2, ba nguyên tử H ở vị trí ortho và para so với nhóm NH2 trong nhân thơm của anilin dễ bị thay thế bởi ba nguyên tử brom
2. Điều kiện phản ứng Anilin tác dụng với brom
Nhiệt độ thường
3. Cách tiến hành thí nghiệm Anilin tác dụng với brom
Nhỏ vài giọt nước brom vào ống nghiệm đựng sẵn 1 ml anilin, thấy ông nghiệm xuất hiện kết tủa trắng
4. Tính chất của Anilin
Anilin là chất lỏng, sôi ở 184°C, không màu, rất độc, tan ít trong nước nhưng tan trong etanol và benzen.
Để lâu trong không khí, anilin chuyển sang màu đen vì bị oxi hóa bởi oxi trong không khí
Phản ứng cháy
4C6H5NH2 + 31O2 → 24CO2 + 14H2O + 2N2
Anilin phản ứng với axit mạnh tạo thành ion anilium
C6H5NH2 + HCl → C6H5NH3+Cl-
C6H5NH2+ HNO2 + HCl → C6H5N2Cl + 2H2O

5. Các phương trình hóa học khác
2CH3COOH + 2Na → 2CH3COONa + H2
6. Bài tập vận dụng liên quan
Câu 1. Phát biểu nào sau đây sai?
A. Anilin tác dụng với nước brom tạo thành kết tủa màu vàng.
B. Amino axit là hợp chất hữu cơ tạp chức.
C. Dung dịch axit glutamic làm quỳ tím chuyển màu hồng.
D. Dung dịch glyxin không làm đổi màu phenolphtalein.
Đáp án A
Nhỏ vài giọt nước brom vào ống nghiệm đựng sẵn 1 ml anilin, thấy ông nghiệm xuất hiện kết tủa trắng.
Phương trình phản ứng minh họa
C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr
Câu 2. Cho các phát biểu sau:
a) Anilin tác dụng với nước brom tạo thành kết tủa trắng
b) Phản ứng giữa buta-1,3-dien với acrilonitrin là phản ứng đồng trùng hợp.
c) Anilin có khả năng làm đổi màu quỳ tím thành xanh vì có tính bazo
d) Dung dịch mantozơ tác dụng với Cu(OH)2/OH- khi đun nóng cho kết tủa Cu2O
Trong các phát biểu trên, số phát biểu không đúng là
A. 1
B. 4
C. 2
D. 3
Đáp án D
a) Đúng
C6H5NH2 + 3Br2 → C6H2Br3NH2+ 3HBr
b) Phản ứng giữa buta-1,3-dien với acrilonitrin là phản ứng đồng trùng hợp.
c) Sai vì Do –NH2 gắn trực tiếp lên vòng benzen làm giảm mật độ electron ở nguyên tử N mạnh. ⇒ tính bazơ của anilin yếu hơn hẳn so với NH3 ⇒ không làm đổi màu quỳ tím
d) Đúng Dung dịch mantozơ tác dụng với Cu(OH)2/OH- khi đun nóng cho kết tủa Cu2O
Câu 3. Có 3 chất lỏng benzen, anilin, stiren đựng riêng biệt trong 3 lọ mất nhãn. Thuốc thử để phân biệt 3 chất lỏng trên là
A. giấy quì tím.
B. nước brom.
C. dung dịch NaOH.
D. dung dịch phenolphtalein.
Trích mẫu thử và đánh số thứ tự
Ta dùng dung dịch brom
Mẫu thử nào xuất hiện tạo kết tủa trắng chất ban đầu là Anilin
C6H5NH2 + 3Br2 C6H2Br3NH2 + 3HBr
Stiren làm mất màu dung dịch brom tạo dung dịch trong suốt.
C6H5-CH=CH2 + Br2 → C6H5-CHBr-CH2Br
Mẫu thử không có hiện tượng gì thì dung dịch ban đầu chính là Benzen
Câu 4. Chất nào sau đây thuộc loại amin bậc một?
A. (CH3)3N.
B. CH3NHCH3.
C. CH3NH2.
D. CH3CH2NHCH3.
Chất nào sau đây thuộc loại amin bậc một?
Loại A vì (CH3)3N là amin bậc III
Loại B vì CH3NHCH3 là amin bậc II
Đúng C CH3NH2là amin bậc I
Loại D vì CH3CH2NHCH3 là amin bậc II
Câu 5. Số đồng phân amin bậc một, chứa vòng benzen, có cùng công thức phân tử C7H9N là:
A. 3.
B. 5.
C. 2.
D. 4.
k = π + v =(2.7 − 9 + 2 + 1)/2 = 4
=> Số đồng phân amin bậc một, chứa vòng benzen, có cùng công thức phân tử C7H9N là 4
Câu 6. Nguyên nhân gây nên tính bazơ của amin là:
A. Do phân tử amin bị phân cực mạnh.
B. Do amin tan nhiều trong H2O.
C. Do nguyên tử N có độ âm điện lớn nên cặp e chung của nguyên tử N và H bị hút về phía N.
D. Do nguyên tử N còn cặp eletron tự do nên phân tử amin có thể nhận proton.
Chất hoặc ion có tính bazơ nếu nó có khả năng nhận proton. (Theo thuyết bonsted)
Do nguyên tử N còn cặp eletron tự do nên phân tử amin có thể nhận proton.
Câu 7. Anilin (C4H9NH2) phản ứng với dung dịch
A. NaOH.
B. HCl.
C. Na2CO3.
D. NaCl.
Anilin (C4H9NH2) phản ứng với dung dịch HCl.
Phương trình phản ứng minh họa
C4H9NH2 + HCl → C4H9NH3ClCâu 8. Để rửa sạch lọ đã đựng anilin người ta dùng
A. dung dịch NaOH và nước.
B. dung dịch HCl và nước.
C. dung dịch amoniac và nước.
D. dung dịch NaCl và nước.
Anilin không tan trong nước, dễ bám vào thành lọ, cho dung dịch HCl vào anilin, phản ứng tạo muối tan trong nước → bị rửa trôi bởi nước.
Phương trình phản ứng minh họa
C6H5NH2 + HCl → C6H5NH3Cl.
Câu 9. Hỗn hợp A gồm Alanin và axit glutamic. Cho a gam B tác dụng hoàn toàn với dd NaOH dư, thu được dung dịch C chứa (a + 30,8) gam muối. Mặt khác, nếu cho a gam A tác dụng hoàn toàn với dung dịch HCl, thu được dung dịch C chứa (a + 36,5) gam muối. Giá trị của a là?
A. 112,2 gam
B. 224,2 gam
C. 168,15 gam
D. 280,5 gam
Đặt nalanin = x mol; naxit glutamic = y mol
Coi phản ứng như sau ta có:
- NH2 + HCl → -NH3Cl
- COOH + NaOH → -COONa + H2O
=> nHCl = x + y = (a + 36,5 - a)/36,5 = 1 mol
nNaOH = x + 2y = (a+30,8-a)/(23 - 1) = 1,4 mol
⇒ x = 0,6 mol; y = 0,4 mol
⇒ m = 112,2 g
Câu 10. Cho 6,615 gam axit glutamic phản ứng với 100 ml dung dịch HCl 1M thu được dung dịch X. Cho 200 ml dung dịch NaOH 1M vào X được Y. Cô cạn Y thu được a gam rắn khan, biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
A. 31,310.
B. 28,890.
C. 14,845.
D. 29,690.
Axit glutamic có dạng: HOOC–CH2–CH2–CH(NH2)–COOH
⇒ naxit glutamic = 0,045 mol
Có nHCl= 0,1 mol; nNaOH = 0,2 mol
⇒ nNaOH dư = nNaOH ban đầu – (2nGlutamic+ nHCl) = 0,01 mol
⇒ Chất rắn khan gồm:
0,01 mol NaOH;
0,045 mol NaOOC – CH2 – CH2– CH(NH2) – COONa;
0,1 mol NaCl ⇒ m = 29,69 gam
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.