Với giải Câu hỏi trang 51 SGK Hoá học10 Cánh Diều Bài 9: Quy tắc Octet giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hoá học 10. Mời các bạn đón xem:
Hoá học 10 Cánh Diều trang 51 Bài 9: Quy tắc Octet
Luyện tập 2 trang 51 Hóa học 10: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ sơ đồ (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8)
b) Li (Z = 3) và F (Z = 9)
c) Mg (Z = 12) và P (Z = 15)
Lời giải:
a) K (Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1. Vậy K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
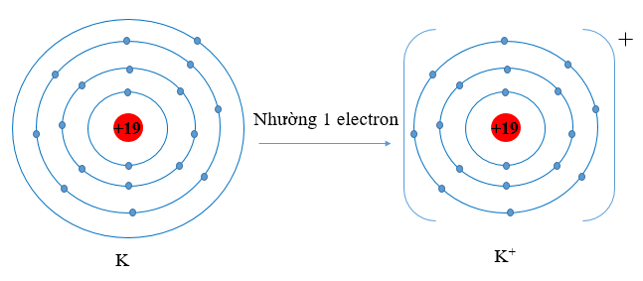
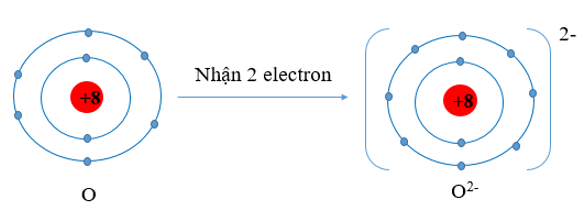
O (Z = 8) có cấu hình electron là 1s22s22p4. Vậy O có 6 electron lớp vỏ ngoài cùng nên nguyên tử O có xu hướng nhận thêm 2 electron để trở thành ion mang điện tích âm, kí hiệu là O2-
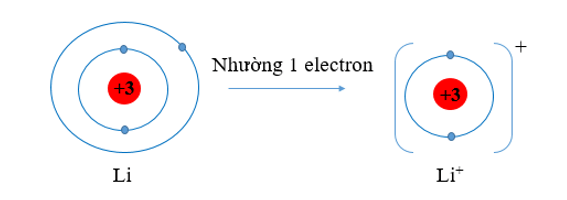
b) Li (Z = 3) có cấu hình electron là: 1s22s1. Vậy Li có 1 electron lớp vỏ ngoài cùng. Nguyên tử Li có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là Li+.
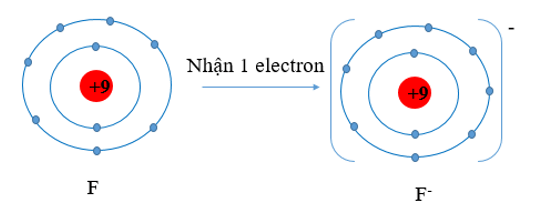
F (Z = 9) có cấu hình electron là: 1s22s22p5. Vậy F có 7 electron lớp vỏ ngoài cùng. Nguyên tử F có xu hướng nhận thêm 1 electron để trở thành ion mang điện tích âm, kí hiệu là F-.
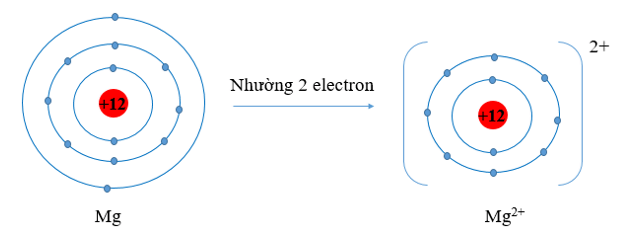
c) Mg (Z = 12) có cấu hình electron là: 1s22s22p63s2. Vậy Mg có 2 electron lớp vỏ ngoài cùng. Nguyên tử Mg có xu hướng nhường đi 2 electron để trở thành ion mang điện tích dương, kí hiệu là Mg2+.
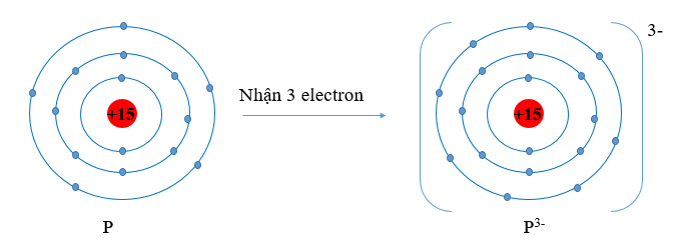
P (Z = 15) có cấu hình electron là: 1s22s22p63s23p3. Vậy P có 5 electron lớp vỏ ngoài cùng. Nguyên tử P có xu hướng nhận thêm 3 electron để trở thành ion mang điện tích âm, kí hiệu là P3-.
Lời giải:
Các nguyên tố thuộc chu kì 2, có 2 lớp electron. Lại có, lớp thứ 2 có 4 AO, mà mỗi AO có tối đa 2 electron nên các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron.
Xem thêm các bài giải Hóa học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 5 trang 52 Hóa học 10: Cho một số hydrocarbon sau: H-C≡C-H, H2C=CH2 và H3C-CH3...
Xem thêm các bài giải Hoá học lớp 10 Cánh Diều hay, chi tiết khác:
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.