Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Quy tắc octet Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Quy tắc octet Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Khái niệm liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Ví dụ:
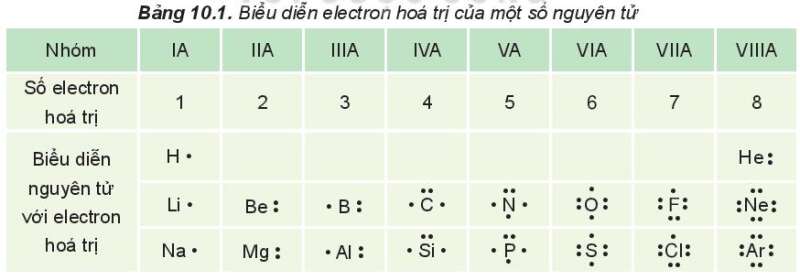
II. Quy tắc octet
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Ví dụ 1: Xét sự hình thành liên kết hóa học trong phân tử Cl2.
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5.
Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
Phân tử Cl2 được biểu diễn:

Xung quanh mỗi nguyên tử Cl đều có 8 electron.
Ví dụ 2: Xét sự hình thành liên kết hóa học trong phân tử NaF.
Cấu hình electron của nguyên tử:
Na (Z = 11): [Ne]3s1 → có 1 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p5 → có 7 electron lớp ngoài cùng.
Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
Bài tập
Câu 1. Theo quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng
A. nhận electron để hình thành lớp vỏ bền vững.
B. nhường electron để hình thành lớp vỏ bền vững.
C. hình thành lớp vỏ bền vững như của khí hiếm.
D. góp chung electron để hình thành lớp vỏ bền vững.
Đáp án: C
Quy tắc octet: “Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm”.
Câu 2. Cho nguyên tử các nguyên tố sau: Na (Z = 11); P (Z = 15); Ne (Z = 10). Trong các nguyên tử trên, nguyên tử có lớp electron ngoài cùng bền vững là
A. Ne.
B. Na.
C. P.
D. Ne và Na.
Đáp án: A
Nguyên tử khí hiếm có lớp electron ngoài cùng đã bão hòa với 8 electron (ngoại lệ là He với lớp electron ngoài cùng bão hòa 2 electron) nên các nguyên tử khí hiếm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác.
Cấu hình electron nguyên tử:
Na (Z = 11): 1s22s22p63s1 → có 1 electron lớp ngoài cùng.
P (Z = 15): 1s22s22p63s23p3 → có 5 electron lớp ngoài cùng.
Ne (Z = 10): 1s22s22p6 → có 8 electron lớp ngoài cùng.
→ Nguyên tử có lớp electron ngoài cùng bền vững là Ne.
Câu 3. Nguyên tử chlorine có Z = 17. Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Đáp án: B
Cấu hình electron nguyên tử của chlorine (Cl): 1s22s22p63s23p5 (có 7 electron ở lớp vỏ ngoài cùng).
→ Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là nhận thêm 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ar (thay vì Cl phải nhường đi 7 electron để có lớp vỏ ngoài cùng là 2s22p6 – khó khăn hơn rất nhiều).
Câu 4. Oxygen có Z = 8, xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là
A. nhận 2 electron.
B. nhường 2 electron.
C. nhận 1 electron.
D. nhường 1 electron.
Đáp án: A
Cấu hình electron của nguyên tử oxygen (Z = 8): 1s22s22p4.
Nguyên tử oxygen có 6 electron lớp ngoài cùng → xu hướng nhận thêm 2 electron để đạt được lớp vỏ bền vững như của khí hiếm (8 electron lớp ngoài cùng).
Câu 5. Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng
A. nhường 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
B. nhường 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
C. nhận 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
D. nhận 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
Đáp án: C
Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng. Trong cùng chu kì, các nguyên tử có lớp electron ngoài cùng với 7 electron (các halogen) dễ nhận thêm electron hơn nên có tính phi kim mạnh nhất.
Câu 6. Nguyên tử sodium có Z = 11. Xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là
A. nhường 2 electron.
B. nhường 1 electron.
C. nhận 2 electron.
D. nhận 1 electron.
Đáp án: B
Cấu hình electron nguyên tử của sodium (Z = 11): [Ne]3s1, có 1 electron ở lớp vỏ ngoài cùng.
→ Vậy xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là nhường đi 1 electron để đạt được lớp vỏ 8 electron ở lớp ngoài cùng như của khí hiếm Ne (thay vì sodium phải nhận thêm 7 electron để có lớp vỏ ngoài cùng là 3s23p6 – khó khăn hơn rất nhiều).
Câu 7. Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng
A. nhận 1, 2 hoặc 3 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
B. nhận 7, 6 hoặc 5 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
C. nhường 7, 6 hoặc 5 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
D. nhường 1, 2 hoặc 3 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
Đáp án: D
Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường 1, 2 hoặc 3 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng. Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng (các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
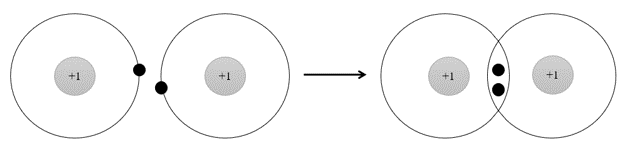
Câu 8. Phân tử H2 được hình thành từ
A. 2 nguyên tử H, trong đó mỗi nguyên tử H nhường đi 1 electron.
B. 2 nguyên tử H bởi sự góp chung electron.
C. 2 nguyên tử H, trong đó mỗi nguyên tử H nhận thêm 1 electron.
D. 2 nguyên tử H, trong đó 1 nguyên tử H nhận thêm 1 electron và 1 nguyên tử H nhường đi 1 electron.
Đáp án: B
Phân tử H2 được hình thành từ 2 nguyên tử H bởi sự góp chung electron. Sau khi hình thành liên kết, xung quanh mỗi nguyên tử H có 1 đôi electron chung, giống lớp vỏ bền vững của khí hiếm He.
Câu 9. Nguyên tử P (Z = 15) có xu hướng
A. nhường 5 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhận 3 electron.
Đáp án: D
Cấu hình electron của nguyên tử P (Z = 15): 1s22s22p63s23p3.
Nguyên tử P có 5 electron ở lớp ngoài cùng → có xu hướng nhận 3 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Câu 10. Nguyên tử Al (Z = 13) có xu hướng
A. nhận 3 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhường 5 electron.
Đáp án: B
Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1.
→ Nguyên tử Al có 3 electron ở lớp ngoài cùng → có xu hướng nhường 3 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Câu 11. Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron (Z = 5).
B. Potassium (Z = 19).
C. Magnesium (Z = 12).
D. Flourine (Z = 9).
Đáp án: B
Boron (Z = 5): 1s22s22p1 → có 3 electron ở lớp ngoài cùng → có xu hướng nhường 3 electron để đạt 2 electron ở lớp ngoài cùng bền vững như khí hiếm He.
Potassium (Z = 19): 1s22s22p63s23p64s1 → có 1 electron ở lớp ngoài cùng → có xu hướng nhường 1 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Magnesium (Z = 12): 1s22s22p63s2 → có 2 electron ở lớp ngoài cùng → có xu hướng nhường 2 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Flourine (Z = 9): 1s22s22p5 → có 7 electron ở lớp ngoài cùng → có xu hướng nhận 1 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
Câu 12. Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phần trăm khối lượng của R trong oxide cao nhất là
A. 25,81%.
B. 67,82%.
C. 32,18%.
D. 74,19%.
Đáp án: D
Cấu hình electron của R+: 1s22s22p6.
Nguyên tử R nhường 1 electron để tạo thành cation R+:
R → R+ + 1e.
→ Cấu hình electron của nguyên tử R: 1s22s22p63s1 (Z = 11).
→ R là Na, có hóa trị I.
Oxide cao nhất của R là: Na2O.
![]()
Câu 13. Cation M+ và anion X- đều có cấu hình electron phân lớp ngoài cùng là 3p6. Cho đơn chất M tác dụng với đơn chất X thu được sản phẩm là
A. NaCl.
B. KCl.
C. NaBr.
D. KBr.
Đáp án: B
Cấu hình electron của cation M+ và anion X-: 1s22s22p63s23p6.
Nguyên tử M nhường 1 electron để tạo thành cation M+:
M → M+ + 1e.
→ Cấu hình electron của nguyên tử M: 1s22s22p63s23p64s1 (Z = 19) → M là kim lọai K.
Nguyên tử X nhận 1 electron để trở thành anion X-:
X + 1e → X-.
→ Cấu hình electron của nguyên tử X: 1s22s22p63s23p5 (Z = 17) → X là phi kim Cl.
Cho đơn chất M tác dụng với đơn chất X: 2K + Cl2 ![]() 2KCl.
2KCl.
Câu 14. Cho 6,72 gam một kim loại M tác dụng với dung dịch H2SO4 loãng, dư, thu được 2,688 lít khí (ở đktc). Kim loại M là
A. Mg.
B. Fe.
C. Zn.
D. Al.
Đáp án: B
Gọi hóa trị của kim loại M là n.
Phương trình hóa học: 2M + nH2SO4 → M2(SO4)n + nH2↑↑.
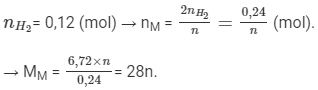
Chọn n = 2 → MM = 56 (amu) → M là kim loại Fe.
Câu 15. Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với lượng dư dung dịch HCl, sau phản ứng thu được 6,72 lít khí ở đktc. Hai kim loại đó là
A. Be và Mg.
B. Ca và Sr.
C. Mg và Ca.
D. Sr và Ba.
Đáp án: C
Gọi công thứ chung của hai kim loại là ![]() (hóa trị II).
(hóa trị II).
Phương trình hóa học: ![]()
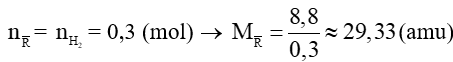
→ Hai kim loại là: Mg (M = 24) và Ca (M = 40).
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.