Toptailieu.vn xin giới thiệu 49 câu trắc nghiệm Phản ứng oxi hóa khử Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
49 câu trắc nghiệm Phản ứng oxi hóa khử Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. ĐỊNH NGHĨA PHẢN ỨNG OXI HOÁ - KHỬ VÀ XÁC ĐINH SỐ OXI HOÁ
1. Định nghĩa phản ứng oxi hoá - khử
Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của một số nguyên tố hay là phản ứng trong đó có sự chuyến electron giữa các chất phản ứng.
2. Xác định số oxi hoá trong hợp chất
Chú ý : Người ta ghi số oxi hoá ở phía trên nguyên tử của nguyên tố. Ghi dấu trước, số sau.
II. CHẤT KHỬ, CHẤT OXI HOÁ, SỰ OXI HOÁ, SỰ KHỬ
- Chất khử là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng.
- Chất oxi hoá là chất nhận electron hay chất có số oxi hoá giảm sau phản ứng.
(Câu thần chú: Chất khử cho tăng, chất o nhận giảm)
- Sự oxi hoá (quá trình OXH) của một chất là làm cho chất đó nhường electron hay làm tăng số oxi hoá chất đó.
- Sự khử (quá trình khử) của một chất là làm cho chất đó nhận electron hay làm giảm số oxi hoá chất đó.
* Sự nhường electron chỉ có thể xảy ra khi có sự nhận electron. Vì vậy sự oxi hoá và sự khử bao giờ
cũng diễn ra đồng thời trong một phản ứng.
* Chất khử tạo nên sự OXH, chất OXH tạo nên sự khử
III. LẬP PHƯƠNG TRÌNH PHẢN ỨNG 0XI HOÁ - KHỬ
Để lập phương trình phản ứng oxi hoá - khử theo phương pháp tháng bằng electron, ta thực hiện các bước sau đây:
Bước 1 : Ghi số oxi hoá của những nguyên tố có số oxi hoá thay đổi :
Bước 2 : Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình :
Bước 3 : Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hoá nhận .
Ví dụ:
![]()
Bước 1 : Xác định số oxi hóa, chất oxi hóa, chất khử
![]()
Chất oxi hóa : ![]() (trong Fe2O3)
(trong Fe2O3)
Chất khử : ![]()
Bước 2 : Viết các quá trình oxi hóa, khử
![]()
(quá trình khử)
![]()
(quá trình oxi hóa)
Bước 3 : Tìm hệ số cho hai quá trình oxi hóa và khử
Bội số chung nhỏ nhất (BSCNN) = 6 do đó hệ số mỗi quá trình như sau:
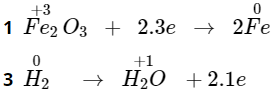
=> Fe2O3 + 3H2 → 2Fe + 3H2O
Bài tập
Bài 1: Số electron mà 1 mol Cu2S đã nhường là :
A. 9 electron. B. 6 electron. C. 2 electron. D. 10 electron.
Lời giải:
Đáp án D
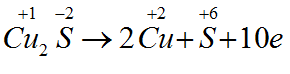
Bài 2: Hệ số cân bằng của HNO3 là:
A. 10 B. 22 C. 26 D. 15
Lời giải:
Đáp án B
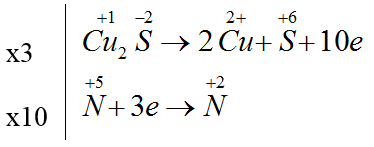
3Cu2S + 22HNO3 → 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
Bài 3: Cho phản ứng : Fe2+ + MnO4- + H+ → Fe3+ + Mn2+ + H2O. Sau khi cân bằng, tổng các hệ số (có tỉ lệ nguyên và tối giản nhất) là :
A. 22. B. 24. C. 18. D. 16.
Lời giải:
Đáp án B
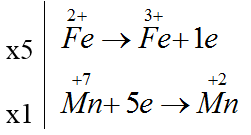
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Tổng các hệ số (có tỉ lệ nguyên và tối giản nhất) là = 5 + 1+ 8 + 5+ 1+4 = 24
Bài 4: Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
A. nhường 12 electron.
B. nhận 13 electron.
C. nhận 12 electron.
D. nhường 13 electron.
Lời giải:
Đáp án D
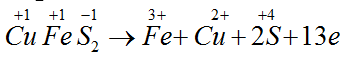
Bài 5: Cho quá trình: NO3- + 3e + 4H+ → NO + 2H2O. Đây là quá trình :
A. oxi hóa. B. khử. C. nhận proton. D. tự oxi hóa – khử.
Lời giải:
Đáp án B.
Bài 6: Trong phản ứng FexOy + HNO3 → N2 + Fe(NO3)3 + H2O, một phân tử FexOy sẽ
A. nhường (2y – 3x) e.
B. nhận (3x – 2y) e.
C. nhường (3x – 2y) e.
D. nhận (2y – 3x) e.
Lời giải:
Đáp án C.
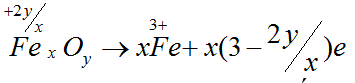
Bài 7: Trong dãy các chất sau, dãy chất nào luôn luôn là chất oxi hóa khi tham gia các phản ứng oxi hóa – khử :
A. KMnO4, Fe2O3, HNO3.
B. Fe, Fe2O3, HNO3.
C. HNO3, H2S, SO2.
D. FeCl2, I2, HNO3.
Lời giải:
Đáp án A.
Trong các hợp chất, số oxi hóa lần lượt là: 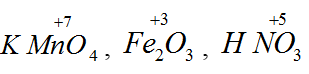
Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O.
Bài 8: Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3: 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
A. 44: 6: 9. B. 46: 9: 6. C. 46: 6: 9. D. 44: 9: 6.
Lời giải:
Đáp án D
Bài 9: Hệ số của HNO3 sau khi cân bằng là:
A. 213 B. 126 C. 162 D. 132
Lời giải:
Đáp án C.
Ta có: tỉ lệ số mol giữa N2O và N2 là 3: 2
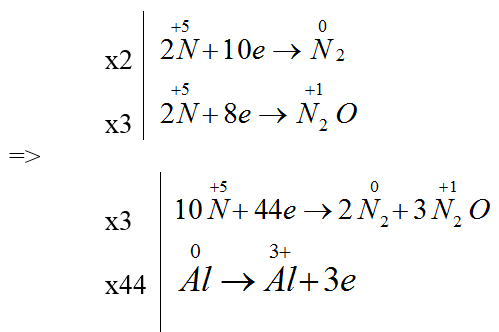
Pt sau cân bằng: 44Al + 162HNO3 → 44Al(NO3)3 + 6N2 + 9N2O + 81H2O.
Bài 10: Cho các chất và ion sau : Zn ; Cl2 ; FeO ; Fe2O3 ; SO2 ; H2S ; Fe2+ ; Cu2+ ; Ag+. Số lượng chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là:
A. 2. B. 8. C. 6. D. 4.
Lời giải:
Đáp án D.
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, FeO, SO2, Fe2+
Bài 11: Cho sơ đồ phản ứng : aFeS +bH+ + cNO3- → Fe3+ + SO42- + NO + H2O. Sau khi cân bằng, tổng hệ số a + b + c là
A. 3. B. 4. C. 6. D. 8.
Lời giải:
Đáp án D.
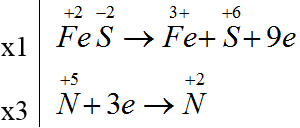
FeS + 4H+ + 3NO3- → Fe3+ + SO42- + 3NO + 2H2O
Tổng hệ số a + b + c = 1 + 4 + 3= 8
Bài 12: Hòa tan hết 1,84 gam hỗn hợp Cu và Fe trong dung dịch HNO3 dư, thu được 0,01 mol NO và 0,04 mol NO2. Số mol Fe và Cu trong hỗn hợp ban đầu lần lượt là :
A. 0,02 và 0,03.
B. 0,01 và 0,02.
C. 0,01 và 0,03.
D. 0,02 và 0,04.
Lời giải:
Đáp án B.
Gọi nCu = y, nFe = x mol
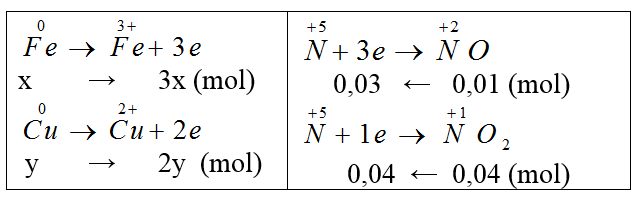
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,07 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 1,84 (2).
Giải 1,2 ta có: x = 0,01, y = 0,02 (mol)
Bài 13: Cho dãy các chất và ion : Cl2, Br2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hoá và tính khử là:
A. 3. B. 4. C. 6. D. 5.
Lời giải:
Đáp án B.
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, SO2, Fe2+, Mn2+.
Bài 14: Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là :
A. 25,6 gam. B. 16 gam. C. 2,56 gam. D. 8 gam.
Lời giải:
Đáp án A
Gọi nNO = x mol, nNO2 = y mol.
Ta có: x + y= 8,6/22,4 = 0,4 (1)
30x + 46y = 19.2.0,4 (2)
Giải 1,2 ta có x = 0,2, y = 0,2 mol.
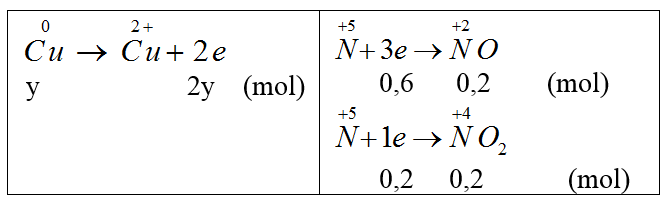
Bảo toàn e: 2y = 0,8 ⇒ y = 0,4 (mol). ⇒ mCu = 0,4.64 = 25,6 (g).
Bài 15: Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là:
A. 8. B. 6. C. 5. D. 7.
Lời giải:
Đáp án D.
Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử xảy ra giữa HNO3 với lần lượt các chất: Fe, FeO, Fe(OH)2, Fe3O4,Fe(NO3)2, FeSO4,FeCO3. (Hợp chất mà trong đó Fe chưa đạt số oxi hóa là +3).
Bài 16: Xét phản ứng sau :
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1);
2NO2 + 2KOH → KNO2 + KNO3 + H2O (2)
Phản ứng (1), (2) thuộc loại phản ứng
A. oxi hóa – khử nội phân tử.
B. oxi hóa – khử nhiệt phân.
C. tự oxi hóa – khử.
D. không oxi hóa – khử.
Lời giải:
Đáp án C.
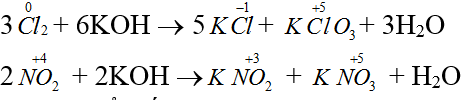
Sự thay đổi số oxi hóa xảy ra chỉ trên 1 nguyên tố là phản ứng tự oxi hóa – khử.
Bài 17: Hòa tan 4,59 gam Al bằng dung dịch HNO3 dư thu được hỗn hợp khí NO và N2O có tỉ khối hơi đối với hiđro bằng 16,75 (ngoài ra không có sản phẩm khử nào khác). Thể tích (đktc) NO và N2O thu được lần lượt là :
A. 2,24 lít và 6,72 lít.
B. 2,016 lít và 0,672 lít.
C. 0,672 lít và 2,016 lít.
D. 1,972 lít và 0,448 lít.
Lời giải:
Đáp án B
nAl = 0,17 (mol).
Gọi nNO = x mol, nN2O = y mol
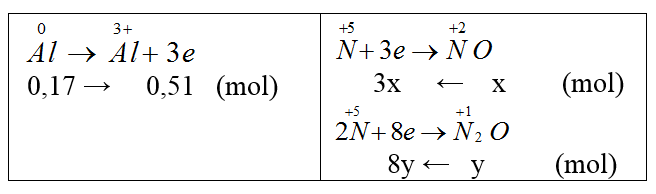
Bảo toàn e: 3x + 8y = 0,51 (1)
Mhh = 16,75.2 = 33,5 = (30x + 44y)/(x+y) (2)
Giải 1 và 2 ta có: x =0,09 (mol); y = 0,03 (mol)
VNO = 0,09.22,4 = 2,016 (l), VN2O = 0,672 (l)
Cho các phản ứng oxi hoá – khử sau :
(1) 3I2 + 3H2O → HIO3 + 5HI
(2) 2HgO → 2Hg + O2
(3) 4K2SO3 → 3K2SO4 + K2S
(4) NH4NO3 → N2O + 2H2O
(5) 2KClO3 → 2KCl + 3O2
(6) 3NO2 + H2O → 2HNO3 + NO
(7) 4HClO4 → 2Cl2 + 7O2 + 2H2O
(8) 2H2O2 → 2H2O + O2
(9) Cl2 + Ca(OH)2 → CaOCl2 + H2O
(10) 2KMnO4 → K2MnO4 + MnO2 + O2
Bài 18: Trong số các phản ứng oxi hoá – khử trên, số phản ứng oxi hoá – khử nội phân tử là:
A. 2. B. 3. C. 4. D. 5.
Lời giải:
Đáp án D
Bài 19: Trong số các phản ứng oxi hoá – khử trên, số phản ứng tự oxi hoá – khử là :
A. 6. B. 7. C. 4. D. 5.
Lời giải:
Đáp án D
Phản ứng oxi hóa khử nội phân tử là phản ứng mà sự thay đổi số oxi hóa xảy ra tại các nguyên tố trong cùng 1 phân tử. Các phản ứng oxi hóa – khử nội phân tử là: 2, 5, 7, 8, 9
Phản ứng tự oxi hóa – tự khử là phản ứng sự tăng giảm số oxi hóa xảy ra trên cùng một nguyên tố.
Các phản ứng oxi hóa – khử nội phân tử là: 1, 3, 4, 6, 10
Bài 20: Cho sơ đồ phản ứng : Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
Hệ số cân bằng của Cu2S và HNO3 trong phản ứng là :
A. 1 và 22. B. 1 và 14. C. 1 và 10. D. 1 và 12.
Lời giải:
Đáp án B
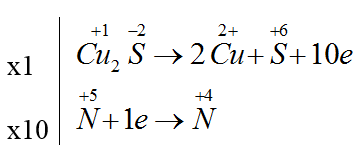
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Bài 21: Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, chỉ thu được sản phẩm khử là 0,896 lít (đktc) hỗn hợp khí gồm NO và N2, có tỉ khối so với H2 bằng 14,75. % theo khối lượng của sắt trong hỗn hợp ban đầu là :
A. 61,80%. B. 61,82%. C. 38,18%. D. 38,20%.
Lời giải:
Đáp án C
nNO = x mol, nH2 = y mol
x + y= 0,896/22,4 = 0,04 mol (1)
30x + 28y = mhh = 14,75.2.0,04 (2)
Giải 1,2 ta có x = 0,03, y =0,01 (mol)
Gọi nFe = a mol, nMg = b mol.
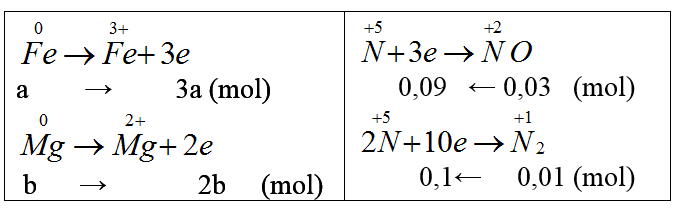
Ta có: 56a + 24b = 2,64 (*)
3a + 2b = 0,19 (**) (Bảo toàn e).
Giải (*), (**): a = 0,018 mol; b = 0,068 mol.
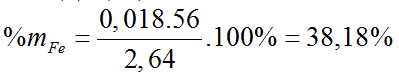
Bài 22: Có phản ứng: X + HNO3 → Fe(NO3)3 + NO + H2O. Số chất X có thể thực hiện phản ứng trên là:
A. 3. B. 4. C. 5. D. 6
Lời giải:
Đáp án C
X là các hợp chất của Fe+2: Fe(NO3)2, FeO, Fe(OH)2 và Feo , Fe3O4
Bài 23: Cho sơ đồ phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O.
Sau khi cân bằng, tỉ lệ giữa số phân tử bị oxi hoá và số phân tử bị khử là
A. 3:1. B. 28:3. C. 3:28. D. 1:3.
Lời giải:
Đáp án A.
Ta có các quá trình :
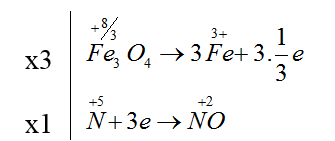
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Chất khử chất oxi hóa (số phân tử HNO3 đóng vai trò làm chất oxi hóa là 1).
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.
Bài 24: Cho 9,2 gam hỗn hợp gồm Zn và Al phản ứng hoàn toàn với lượng dư dung dịch H2SO4 đặc, nóng thu được 5,6 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Khối lượng Al có trong hỗn hợp là
A. 2,7 gam. B. 5,4 gam C. 8,1 gam. D. 6,75 gam.
Lời giải:
Đáp án A
nSO2 = 5,6/22,4 = 0,25 mol
Gọi nAl = a mol, nZn = b mol.
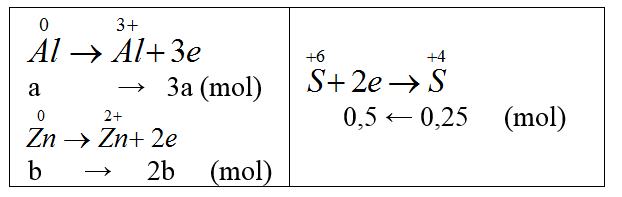
Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
mAl = 0,1.27 = 2,7 gam
Bài 25: Hoà tan hoàn toàn 2,16 gam kim loại M hóa trị III bởi lượng dư dung dịch H2SO4 đặc, nóng thu được 2,688 gam khí SO2 (là sản phẩm khử duy nhất). M là
A. Fe. B. Cu. C. Zn. D. Al.
Lời giải:
Đáp án D.
nSO2 = 2,688/22,4 = 0,12 mol
Ta có:
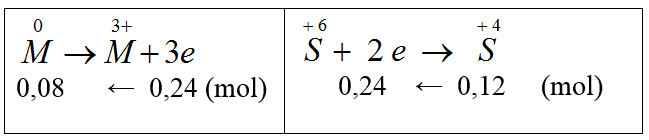
MM = 2,16/0,08 = 27 (Al)
Bài 26: Cho phản ứng: Fe3O4 + HNO3loãng → ....
Tỉ lệ giữa số phân tử Fe3O4 với số HNO3 đóng vai trò môi trường là
A. 1/1. B. 3/1. C. 1/9. D. 3/28.
Lời giải:
Đáp án C
Fe3O4 + HNO3loãng → Fe(NO3)3 + NO + H2O
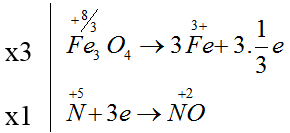
3Fe3O4 + 28HNO3loãng → 9Fe(NO3)3 + NO + 14H2O
Số phân tử HNO3 đóng vai trò làm môi trường = 27.
Tỉ lệ giữa số phân tử Fe3O4 với số HNO3 đóng vai trò môi trường = 3:27 = 1/9
Bài 27: Hòa tan hoàn toàn hỗn hợp gồm 0,05 mol Ag và 0,03 mol Cu vào dung dịch HNO3 dư thu được hỗn hợp khí X gồm NO và NO2 có tỉ lệ mol tương ứng là 2 : 3. Thể tích khí X (đktc) là:
A. 2,224 B. 2,737 C. 1,368 D. 3,374
Lời giải:
Đáp án C
nNO = 2x mol; nNO2 = 3x mol
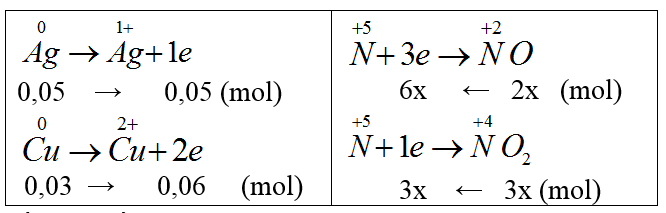
Bảo toàn e ta có:
9x = 0,11; x= 11/900 ⇒ V = 5x.22,4 = 1,368 (l)
Bài 28: Từ 2 phản ứng:
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Cu2+ + Fe → Cu + Fe2+
Có thể rút ra kết luận:
A. Tính oxi hoá: Fe3+ > Cu2+ > Fe2+
B. Tính khử: Fe > Fe2+ > Cu
C. Tính oxi hoá: Fe3+ > Fe2+ > Cu2+
D. Tính khử: Cu > Fe > Fe2+
Lời giải:
Đáp án A.
Bài 29: Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NxOy + H2O
Sau khi cân bằng, hệ số của HNO3 là
A. 13x - 9y. B. 23x - 9y. C. 23x - 8y. D. 16x - 6y.
Lời giải:
Đáp án D.
Ta có :
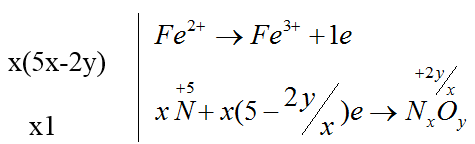
(5x-2y)FeO + (16x-6y)HNO3 → (5x-2y)Fe(NO3)3 + NxOy + (8x-3y)H2O
Bài 30: Hòa tan hoàn toàn 13,0 gam Zn vào dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 18,9 gam B. 37,80 gam C. 28,35 gam D. 39,80 gam
Lời giải:
Đáp án D
nZn = 0,2 (mol),
Do số mol e nhường < số mol e nhận, sản phẩm khử phải có NH4NO3.
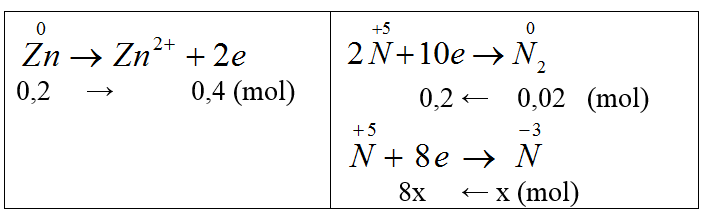
Bảo toàn e ta có: 0,4 = 0,2 + 8x ⇒ x = 0,025 (mol)
mmuối = mKL + ne.mNO3 + mNH4NO3 = 13 + 0,4.62 + 0,025. 80 = 39,8 gam.
Bài 31: Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng của các chất trong phản ứng là:
A. 21. B. 19. C. 23. D. 25.
Lời giải:
Đáp án B
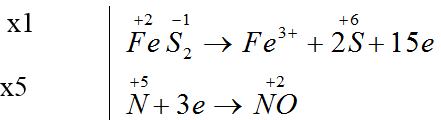
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Tổng hệ số cân bằng của các chất trong phản ứng là = 1 + 8+ 1+ 2+ 5 + 2= 19
Bài 32: Cho 13,5 gam nhôm tác dụng vừa đủ với 2,5 lít dung dịch HNO3, phản ứng tạo ra muối nhôm và một hỗn hợp khí gồm NO và N2O(là sản phẩm khử duy nhất). Tính nồng độ mol của dung dịch HNO3. Biết rằng tỉ khối của hỗn hợp khí đối với hiđro bằng 19,2.
A. 0,95. B. 0,86. C. 0,76. D. 0,9.
Lời giải:
Đáp án C
nAl = 0,5 mol
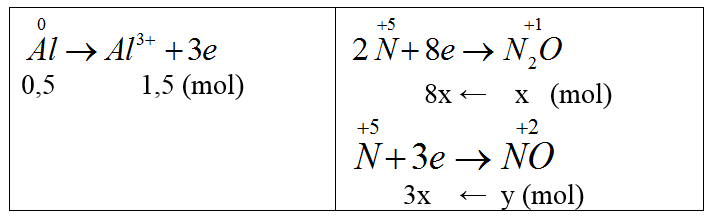
Bảo toàn e ta có: 1,5 = 8x + 3y (1)
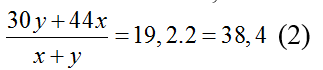
Giải (1), (2) ta có: x = 0,15 , y =0,1 (mol)
nHNO3 = 4nNO + 10nN2O = 4y + 10x = 1.9 (mol)
CHNO3 = 1,9/2,5 = 0,76 M
Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất.
Bài 33: Phần trăm thể tích của oxi trong Y là
A. 40% B. 50% C. 60% D. 70%
Lời giải:
Đáp án: C
Ta có mX + mY = mZ ⇒ 7,8 + mY = 19,7
mY = 11,9 (g)
Gọi nCl2 = x mol; nO2 = y mol
Ta có x + y = 5,6/22,4 = 0,25 mol (1)
mCl2 + mO2 = 71x + 32y = 11,9 (2)
Giải (1) và (2) ta có x = 0,1 (mol); y = 0,15(mol)
%VO2 = 0,15/0,25 . 100% = 60%
Bài 34: Cho phản ứng sau:
Na2SO3 + KMnO4 + KHSO4 → Na2SO4 + K2SO4 + MnSO4 + H2O
Sau khi cân bằng với hệ số là những số nguyên tối giản thì hệ số của K2SO4 là
A. 2. B. 3. C. 5. D. 4.
Lời giải:
Đáp án D.
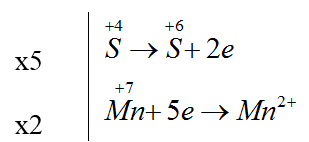
5Na2SO3 + 2KMnO4 + 6KHSO4 → 5Na2SO4 + 4K2SO4 + 2MnSO4 + 3H2O
Bài 35: Trong những phản ứng sau đây, phản ứng nào là phản ứng oxi hóa – khử
a) SO3 + H2O → H2SO4
b) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
c) C + H2O → CO + H2
d) CO2 + Ca(OH)2 → CaCO3 + H2O
e) Ca + 2H2O → Ca(OH)2 + H2
f) 2KMnO4 → K2MnO4 + MnO2 + O2
A. c,e,f B. a,d,e C. a, c, e, D. a,e,f
Lời giải:
Đáp án A
Trong những phản ứng trên chỉ có phản ứng c), e), f) là những phản ứng oxi hóa - khử vì có sự thay đổi số oxi hóa của các nguyên tố.
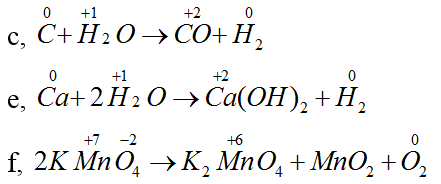
Bài 36: Cho sơ đồ phản ứng : Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O. Sau khi cân bằng, hệ số của phân tử HNO3 là :
A. 23x – 9y. B. 23x – 8y. C. 46x – 18y. D. 13x – 9y.
Lời giải:
Đáp án C
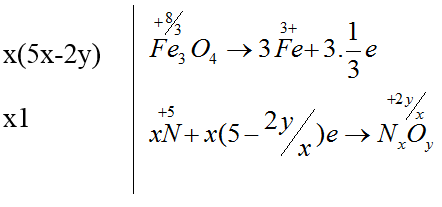
(5x-2y)Fe3O4 + (46x -18y)HNO3 → (15x- 6y)Fe(NO3)3 + NxOy + (23x-9y)H2O
Bài 37: Cho phương trình phản ứng sau:
C6H5C2H5 + KMnO4 → C6H5COOK + MnO2 + K2CO3 + KOH + H2O
Hệ số nguyên tối giản đứng trước chất bị khử khi phản ứng cân bằng là
A. 4. B. 12. C. 3. D. 10.
Lời giải:
Đáp án A.
C6H5C2H5 + 4KMnO4 → C6H5COOK + 4MnO2 + K2CO3 + KOH + 2H2O.
Do số OXH của KMnO4 giảm ⇒ nó là chất oxi hóa nghĩa là trong phản ứng nó bị khử.
⇒ Hệ số cần tìm là 4.
Bài 38: Cho phản ứng hoá học: Tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hoá và số nguyên tử clo đóng vai trò chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là
A. 1:5. B. 5:1. C. 1:3. D. 3:1.
Lời giải:
Đáp án B.
Ta có:
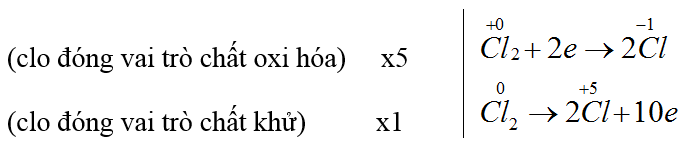
Bài 39: Xét phản ứng : xBr2 + yCrO2- + ...OH- → ...Br- + ...CrO42- + ...H2O. Giá trị của x và y là :
A. 3 và 1. B. 1 và 2. C. 2 và 3. D. 3 và 2.
Lời giải:
Đáp án D
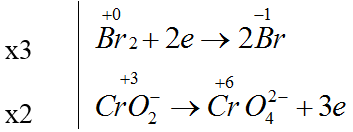
3Br2 + 2CrO2- + ...8OH- → ...6Br- + ...2CrO42- + ...4H2O
Bài 40: Cho phản ứng : Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O. Số phân tử HNO3 đóng vai trò làm chất oxi hóa là?
A.14 B. 10. C. 4. D. 12.
Lời giải:
Đáp án B
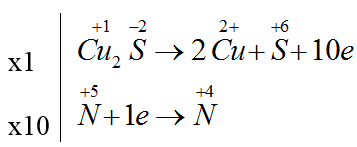
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Số phân tử HNO3 đóng vai trò làm chất oxi hóa là 10.
Bài 41: Cho biết các phản ứng xảy ra sau:
2FeBr2 + Br2 → 2FeBr3 ;
2NaBr + Cl2 → 2NaCl + Br2 . Phát biểu đúng là
A. Tính khử của Cl- mạnh hơn của Br- .
B. Tính oxi hóa của Br2 mạnh hơn của Cl2.
C. Tính khử của Br- mạnh hơn của Fe2+.
D. Tính oxi hóa của Cl2 mạnh hơn của Fe3+.
Lời giải:
Đáp án
Từ phương trình (2) : 2NaBr + Cl2 → 2NaCl + Br2 ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Bài 42: Cho phản ứng : Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O. Số phân tử HNO3 đóng vai trò làm chất oxi hóa là?
A.14 B. 10. C. 4. D. 12.
Lời giải:
Đáp án B
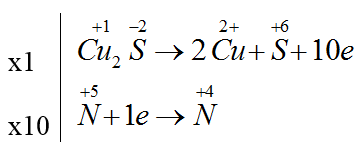
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Số phân tử HNO3 đóng vai trò làm chất oxi hóa là 10.
Bài 43: Cho biết các phản ứng xảy ra sau:
2FeBr2 + Br2 → 2FeBr3 ;
2NaBr + Cl2 → 2NaCl + Br2 . Phát biểu đúng là
A. Tính khử của Cl- mạnh hơn của Br- .
B. Tính oxi hóa của Br2 mạnh hơn của Cl2.
C. Tính khử của Br- mạnh hơn của Fe2+.
D. Tính oxi hóa của Cl2 mạnh hơn của Fe3+.
Lời giải:
Đáp án
Từ phương trình (2): 2NaBr + Cl2 → 2NaCl + Br2 ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Mặt khác từ (1): 2FeBr2 + Br2 → 2FeBr3 nên tính oxi hóa của Br2 mạnh hơn Fe3+.
Bài 44: Cho phản ứng:
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Tổng hệ số cân bằng của chất oxi hóa và chất khử là:
A. 6 B. 8 C.7 D.14
Lời giải:
Đáp án C
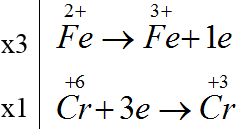
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Chất khử Chất oxi hóa
Tổng hệ số cân bằng của chất oxi hóa và chất khử = 6 + 1 = 7.
Bài 45: Thực hiện các thí nghiệm sau:
(I) Sục khí SO2 vào dung dịch KMnO4.
(II) Sục khí SO2 vào dung dịch H2S.
(III) Sục hỗn hợp khí NO2 và O2 vào nước.
(IV) Cho MnO2 vào dung dịch HCl đặc, nóng.
(V) Cho Fe2O3 vào dung dịch H2SO4 đặc, nóng.
Số thí nghiệm có phản ứng oxi hoá - khử xảy ra là
A. 2. B. 5. C. 4. D. 3.
Lời giải:
Đáp án C.
Các phương trình oxi hóa khử là I, II, III, IV.
Các pt phản ứng xảy ra:
(I): 2KMnO4 + 5SO2 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
(II) SO2 + 2H2S → 3S + 2H2O
(III) 2NO2 + 1/2 O2 + H2O → 2HNO3
(IV) MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
(V) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Bài 46: Trong phản ứng:
K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
A. 3/14. B. 4/7. C. 1/7. D. 3/7.
Lời giải:
Đáp án D
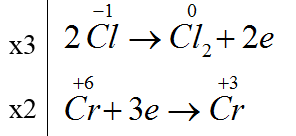
K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Số phân tử HCl đóng vai trò chất khử /tổng số phân tử HCl tham gia phản ứng = 6/14=3/7
Bài 47: Cho các phản ứng:
(a) Sn + HCl (loãng) → (b) Fe + H2SO4 (loãng) →
(c) MnO2 + HCl (đặc) → (d) Cu + H2SO4 (đặc) →
(e) Al + H2SO4 (loãng) → (g) FeSO4 + KMnO4 + H2SO4 →
Số phản ứng mà H của axit đóng vai trò chất oxi hoá là
A. 3. B. 5. C. 2. D. 6.
Lời giải:
Đáp án C
Các phương trình: a, b.
(a) Sn + 2HCl (loãng) → SnCl2 + H2
Chất oxi hóa (sự thay đổi số oxi hóa xảy ra tại H).
(b) Fe + H2SO4 (loãng) → FeSO4 + H2
Chất oxi hóa (sự thay đổi số oxi hóa xảy ra tại H).
(c) MnO2 + 4HCl (đặc) → MnCl2 + Cl2 + 2H2O
Chất khử (sự thay đổi số oxi hóa xảy ra tại Cl)
(d) Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + 2H2O
Chất oxi hóa (sự thay đổi số oxi hóa xảy ra tại S).
(e) 10FeSO4 + 2KMnO2 + 8H2SO2 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Môi trường
Bài 48: Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 3. C. 1. D. 4.
Lời giải:
Đáp án A.
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
Chất khử
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
Không thay đổi số oxi hóa.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
Chất khử
(d) 2HCl + Zn → ZnCl2 + H2.
Chất oxi hóa
Bài 49: Hai kim loại X, Y và các dung dịch muối của chúng có các phản ứng hoá học sau:
Phát biểu đúng là
A. Ion Y2+ có tính oxi hoá mạnh hơn ion X2+.
B. Kim loại X khử được ion Y2+.
C. Kim loại X có tính khử mạnh hơn kim loại Y.
D. Ion Y3+ có tính oxi hoá mạnh hơn ion X2+.
Lời giải:
Đáp án D
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết hydrogen và tương tác van der waals
Bài 14: Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.