Toptailieu.vn xin giới thiệu 30 câu trắc nghiệm Tốc độ phản ứng hóa học Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
30 câu trắc nghiệm Tốc độ phản ứng hóa học Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Khái niệm về tốc độ phản ứng hóa học
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)... Tốc độ phản ứng được xác định bằng thực nghiệm.
2. Tốc độ trung bình
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
Ví dụ: Xét phản ứng aA → bB
Nếu tính tốc độ phản ứng theo chất A: Ở thời điểm t1 chất A có nồng độ C1 mol/lít, ở thời điểm t2 chất A có nồng độ C2 mol/lít. Tốc độ trung bình của phản ứng là:
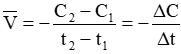
Còn nếu tính tốc độ phản ứng theo chất B thì tốc độ trung bình của phản ứng là:
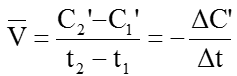
Để tốc độ phản ứng là đơn giá trị người ta sử dụng biểu thức:
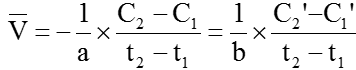
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.
III. Ý nghĩa thực tiễn của tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất.
Ví dụ: Thực phẩm nấu trong nồi áp suất nhanh chín hơn khi nấu áp suất thường.
Các chất đốt như than, củi cháy nhanh hơn khi có kích thước nhỏ.
Bài tập
Bài 1: Cho phản ứng: X → Y
Tại thời điểm t1 nồng độ của chất X bằng C1, tại thời điểm t2 (với t2 > t1), nồng độ của chất X bằng C2. Tốc độ trung bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây ?
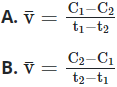
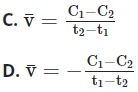
Đáp án: C
Giải thích:
Vì C1 > C2; t2 > t1 →
Bài 2: Khi cho cùng một lượng dung dịch axit sunfuric vào hai cốc đựng cùng một thể tích dung dịch Na2S2O3 với nồng độ khác nhau, ở cốc đựng dung dịch Na2S2O3 có nồng độ lớn hơn thấy kết tủa xuất hiện trước. Điều đó chứng tỏ ở cùng điều kiện về nhiệt độ, tốc độ phản ứng:
A. Không phụ thuộc vào nồng độ của chất phản ứng.
B. Tỉ lệ thuận với nồng độ của chất phản ứng.
C. Tỉ lệ nghịch với nồng độ của chất phản ứng.
D. Không thay đổi khi thay đổi nồng độ của chất phản ứng.
Đáp án: B
Giải thích:
Ở cùng điều kiện về nhiệt độ, tốc độ phản ứng tỉ lệ thuận với nồng độ của chất phản ứng.
Bài 3: Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
A. Nồng độ của các chất khí tăng lên.
B. Nồng độ của các chất khí giảm xuống.
C. Chuyển động của các chất khí tăng lên.
D. Nồng độ của các chất khí không thay đổi.
Đáp án: A
Giải thích:
Ta có: p = ![]()
Mặt khác: n = C.V
Do đó ta có: p = CRT
→ Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do nồng độ của các chất khí tăng lên.
Bài 4: Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nhiệt độ.
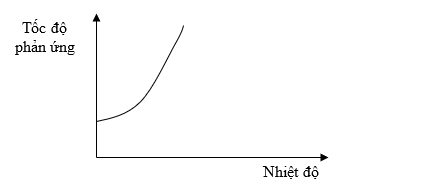
Từ đồ thị trên, ta thấy tốc độ phản ứng:
A. Giảm khi nhiệt độ của phản ứng tăng.
B. Không phụ thuộc vào nhiệt độ của phản ứng.
C. Tăng khi nhiệt độ của phản ứng tăng.
D. Tỉ lệ nghịch với nhiệt độ của phản ứng.
Đáp án: C
Giải thích:
Theo đồ thị ta thấy khi nhiệt độ tăng, tốc độ phản ứng tăng.
Bài 5: Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nồng độ chất phản ứng.
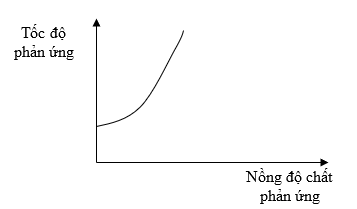
Từ đồ thị trên, ta thấy tốc độ phản ứng
A. Giảm khi nồng độ của chất phản ứng tăng.
B. Không phụ thuộc vào nồng độ của chất phản ứng.
C. Tỉ lệ thuận với nồng độ của chất phản ứng.
D. Tỉ lệ nghịch với nồng độ của chất phản ứng.
Đáp án: C
Giải thích:
Theo đồ thị ta thấy khi nồng độ chất phản ứng tăng, tốc độ phản ứng tăng.
Bài 6: Cho các phương trình hóa học
a) 2SO2 (k) + O2(k) ⇄ 2SO2 (k)
b) H2 (k) + I2(k) ⇄ 2HI(k)
c) CaCO3 (r) ⇄ CaO (r) + CO2 (k)
d) 2Fe2O3 (r) + 3C (r) ⇄ 4Fe (r) + 3CO2 (k)
e) Fe (r) + H2O (h) ⇄ FeO (r) + H2 (k)
f) N2 (k) + 3H2 (k) ⇄ 2NH3 (k)
g) Cl2 (k) + H2S (k) ⇄ 2HCl (k) + S (r)
h) Fe2O3 (r) + 3CO (k) ⇄ 2Fe (r) + 3CO2 (k)
Các phản ứng có tốc độ phản ứng thuận (vt) tăng khi tăng áp suất chung của hệ là:
A. a, f.
B. a, g.
C. a, c, d, e, f, g.
D. a, b, g.
Đáp án: A
Giải thích:
a) Cân bằng chuyển dịch theo chiều thuận → vt tăng
b) Cân bằng không chuyển dịch → vt và vn tăng như nhau
c) Cân bằng chuyển dịch theo chiều nghịch → vt giảm
d) Cân bằng chuyển dịch theo chiều nghịch → vt giảm
e) Cân bằng không chuyển dịch → vt và vn tăng như nhau
f) Cân bằng chuyển dịch theo chiều thuận → vt tăng
g) Cân bằng không chuyển dịch → vt và vn tăng như nhau
h) Cân bằng không chuyển dịch → vt và vn tăng như nhau
Các phản ứng có vt tăng là: a, f
Bài 7: Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây?
A. Dạng viên nhỏ.
B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng.
D. Dạng nhôm dây.
Đáp án: B
Giải thích:
Diện tích tiếp xúc càng lớn thì phản ứng càng dễ xảy ra → khi Al dạng bột là có diện tích tiếp xúc lớn nhất nên tốc độ phản ứng lớn nhất
Bài 8: Khi cho axit clohiđric tác dụng với kali pemanganat (rắn) để điều chế clo, khí clo sẽ thoát ra nhanh hơn khi:
A. Dùng axit clohiđric đặc và đun nhẹ hỗn hợp.
B. Dùng axit clohiđric đặc và làm lạnh hỗn hợp.
C. Dùng axit clohiđric loãng và đun nhẹ hỗn hợp.
D. Dùng axit clohiđric loãng và làm lạnh hỗn hợp.
Đáp án: A
Giải thích:
Nồng độ chất phản ứng tăng và nhiệt độ tăng thì tốc độ phản ứng tăng
Bài 9: Xét phản ứng thuận nghịch sau:
H2 (k) + I2 (k) ⇄ 2HI (k)
Đồ thị biểu diễn sự biến thiên tốc độ phản ứng thuận và phản ứng nghịch theo thời gian:
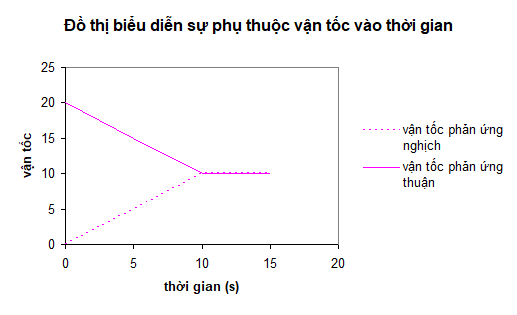
Tại thời điểm nào phản ứng đạt trạng thái cân bằng?
A. 0 giây
B. 5 giây
C. 10 giây
D. 15 giây
Đáp án: C
Giải thích:
Tại điểm giao nhau là úc vt = vn → cân bằng được thiết lập → tcb = 10s
Câu 10: Cho phản ứng nung vôi: CaCO3 → CaO + CO2
Để tăng hiệu suất của phản ứng thì biện pháp nào sau đây không phù hợp?
A. Tăng nhiệt độ trong lò
B. Tăng áp suất trong lò
C. Đập nhỏ đá vôi
D. Giảm áp suất trong lò
Đáp án: B
Giải thích:
Thực ra phản ứng này là một phản ứng thuận nghịch. Tăng áp suất trong lò thì cân bằng sẽ chuyển dịch theo chiều nghịch → giảm hiệu suất
Bài 11: Tốc độ của phản ứng sẽ tăng lên bao nhiêu lần khi tăng nhiệt độ từ 20oC đến 100oC, nếu hệ số nhiệt độ của phản ứng đã cho bằng 2?
A. 256 lần
B. 265 lần
C. 275 lần
D. 257 lần
Đáp án: A
Giải thích:
Cứ tăng 10oC thì tốc độ phản ứng tăng 2 lần
→ Tăng 80oC thì tốc độ phản ứng tăng 28 = 256 lần
Bài 12: Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/l. Sau 10 giây xảy ra phản ứng, nồng độ của chất đó là 0,022 mol/l. Tốc độ phản ứng trong trường hợp này là
A. 0,0003 mol/l.s.
B. 0,00025 mol/l.s.
C. 0,00015 mol/l.s.
D. 0,0002 mol/l.s.
Đáp án: D
Giải thích:
v = ![]() = 0,0002mol/l.s
= 0,0002mol/l.s
Bài 13: Khi nhiệt độ tăng thêm 10o thì tốc độ phản ứng tăng 3 lần. Khi nhiệt độ tăng từ 20o lên 80o thì tốc độ phản ứng tăng lên
A. 18 lần.
B. 27 lần.
C. 243 lần.
D. 729 lần.
Đáp án: D
Giải thích:
Tốc độ tăng số lần là: ![]() = 36 = 729
= 36 = 729
Bài 14: Có phương trình phản ứng: 2A + B → C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức: v = k [A]2.[B]. Hằng số tốc độ k phụ thuộc
A. Nồng độ của chất.
B. Nồng độ của chất B.
C. Nhiệt độ của phản ứng.
D. Thời gian xảy ra phản ứng.
Đáp án: C
Giải thích:
Hằng số k chỉ phụ thuộc vào nhiệt độ của phản ứng.
Bài 15: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4 mol/(l.s)
B. 5,0.10-4 mol/(l.s)
C. 1,0.10-3 mol/(l.s)
D. 5,0.10-5 mol/(l.s)
Đáp án: D
Giải thích:
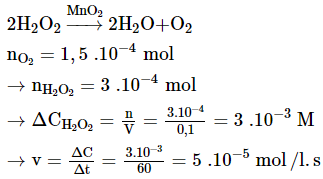
Bài 16: Cho phương trình hóa học của phản ứng tổng hợp amoniac
N2 (k) + 3H2 (k) ![]() 2NH3 (k)
2NH3 (k)
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận
A. tăng lên 8 lần.
B. giảm đi 2 lần.
C. tăng lên 6 lần.
D. tăng lên 2 lần.
Đáp án: A
Giải thích:
v = k.[N2]2.[H2]3
→ Khi tăng nồng độ của hiđro lên 2 lần → v tăng 23 = 8 lần
Bài 17: Cho phản ứng: Br2 + HCOOH → 2HBr + CO2. Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol (l.s). Giá trị của a là
A. 0,018.
B. 0,016.
C. 0,012.
D. 0,014.
Đáp án: C
Giải thích:
a - 0,01 = v.t = 50.4.10-5 → a = 0,012 mol/lít
Bài 18: Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10−4 mol/(l.s).
B. 1,0.10−4 mol/(l.s).
C. 7,5.10−4 mol/(l.s).
D. 5,0.10−4 mol/(l.s).
Đáp án: B
Giải thích:
![]()
Bài 19: Thực hiện phản ứng sau trong bình kín:
H2 (k) + Br2 (k) → 2HBr (k).
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
A. 8.10-4 mol/(l.s).
B. 2.10-4 mol/(l.s).
C. 6.10-4 mol/(l.s).
D. 4.10-4 mol/(l.s).
Đáp án: B
Giải thích:
![]()
Bài 20: Phản ứng giữa hai chất A và B được biểu thị bằng phương trình hóa học sau
A + B → 2C
Tốc độ phản ứng này là V = K.[A].[B]. Thực hiện phản ứng này với sự khác nhau về nồng độ ban đầu của các chất:
Trường hợp 1: Nồng độ của mỗi chất là 0,01 mol/l.
Trường hợp 2: Nồng độ của mỗi chất là 0,04 mol/l
Trường hợp 3: Nồng độ của chất A là 0,04 mol/l, của chất B là 0,01 mol/l.
Tốc độ phản ứng ở trường hợp 2 và 3 lớn hơn so với trường 1 số lần là
A. 12 và 8
B. 13 và 7
C. 16 và 4
D. 15 và 5
Đáp án: C
Giải thích:
TH2, nồng độ mỗi chất tăng lên 4 lần → v tăng lên: 4 . 4 = 16 lần
TH3, nồng độ mỗi chất A tăng lên 4 lần → v tăng lên: 4 . 1 = 4 lần
Bài 21: Cho các phương trình hóa học
a) 2SO2 (k) + O2(k) ⇄ 2SO2 (k)
b) H2 (k) + I2(k) ⇄ 2HI(k)
c) CaCO3 (r) ⇄ CaO (r) + CO2 (k)
d) 2Fe2O3 (r) + 3C (r) ⇄ 4Fe (r) + 3CO2 (k)
e) Fe (r) + H2O (h) ⇄ FeO (r) + H2 (k)
f) N2 (k) + 3H2 (k) ⇄ 2NH3 (k)
g) Cl2 (k) + H2S (k) ⇄ 2HCl (k) + S (r)
h) Fe2O3 (r) + 3CO (k) ⇄ 2Fe (r) + 3CO2 (k)
Các phản ứng có tốc độ phản ứng thuận và nghịch đều tăng như nhau khi tăng áp suất của hệ là
A. a, b, e, f.
B. a, b, c, d, e.
C. b, e, g, h.
D. d, e, f, g.
Đáp án: C
Giải thích:
a) Cân bằng chuyển dịch theo chiều thuận → vt tăng
b) Cân bằng không chuyển dịch → vt và vn tăng như nhau
c) Cân bằng chuyển dịch theo chiều nghịch → vt giảm
d) Cân bằng chuyển dịch theo chiều nghịch → vt giảm
e) Cân bằng không chuyển dịch → vt và vn tăng như nhau
f) Cân bằng chuyển dịch theo chiều thuận → vt tăng
g) Cân bằng không chuyển dịch → vt và vn tăng như nhau
h) Cân bằng không chuyển dịch → vt và vn tăng như nhau
Các phản ứng có vt và vn tăng như nhau là: b, e, g, h
Bài 22: Cho các phương trình hóa học
a) 2SO2 (k) + O2(k) ⇄ 2SO2 (k)
b) H2 (k) + I2(k) ⇄ 2HI(k)
c) CaCO3 (r) ⇄ CaO (r) + CO2 (k)
d) 2Fe2O3 (r) + 3C (r) ⇄ 4Fe (r) + 3CO2 (k)
e) Fe (r) + H2O (h) ⇄ FeO (r) + H2 (k)
f) N2 (k) + 3H2 (k) ⇄ 2NH3 (k)
g) Cl2 (k) + H2S (k) ⇄ 2HCl (k) + S (r)
h) Fe2O3 (r) + 3CO (k) ⇄ 2Fe (r) + 3CO2 (k)
Các phản ứng có tốc độ phản ứng thuận giảm khi tăng áp suất của hệ là
A. a, b, e, f, h.
B. a, b, c, d, e.
C. b, e, h.
D. c, d.
Đáp án: D
Giải thích:
a) Cân bằng chuyển dịch theo chiều thuận → vt tăng
b) Cân bằng không chuyển dịch → vt và vn tăng như nhau
c) Cân bằng chuyển dịch theo chiều nghịch → vt giảm
d) Cân bằng chuyển dịch theo chiều nghịch → vt giảm
e) Cân bằng không chuyển dịch → vt và vn tăng như nhau
f) Cân bằng chuyển dịch theo chiều thuận → vt tăng
g) Cân bằng không chuyển dịch → vt và vn tăng như nhau
h) Cân bằng không chuyển dịch → vt và vn tăng như nhau
Các phản ứng có vt giảm là: c, d
Bài 23: Công thức tính tốc độ phản ứng hóa học theo chất sản phẩm là:
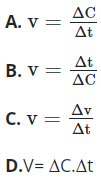
Đáp án: A
Giải thích:
Công thức tính tốc độ phản ứng hóa học theo chất sản phẩm là: v = ![]()
Bài 24: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng?
A. Nung kaliclorat ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxi.
D. Dùng phương pháp dời không khí để thu khí oxi.
Đáp án: B
Giải thích:
Dùng nhiệt độ và chất xúc tác (MnO2) sẽ làm tăng tốc độ của phản ứng
Bài 25: Đối với một hệ ở trạng thái cân bằng, nếu thêm vào chất xúc tác thì:
A. Chỉ làm tăng tốc độ phản ứng thuận
B. Chỉ làm tăng tốc độ phản ứng nghịch
C. Làm tăng tốc độ phản ứng thuận và nghịch với số lần như nhau.
D. Không làm tăng tốc độ của phan ứng thuận và nghịch
Đáp án: C
Giải thích:
Chất xúc tác không làm thay đổi cân bằng hóa học chỉ làm tăng tốc độ của phản ứng nhanh đạt đến trạng thái cân bằng
Bài 26: Hằng số cân bằng của phản ứng xác định chỉ phụ thuộc vào:
A. nhiệt độ.
B. áp suất.
C. chất xúc tác.
D. nồng độ.
Đáp án: A
Giải thích:
Hằng số cân bằng của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
Bài 27: Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng sau:
2KClO3(r) ![]() 2KCl(r) + 3O2(k)
2KCl(r) + 3O2(k)
A. Nhiệt độ
B. Chất xúc tác
C. Áp suất
D. Kích thước của các tinh thể KClO3
Đáp án: C
Giải thích:
Yếu tố áp suất chỉ ảnh hưởng đến chuyển dịch cân bằng chứ không làm tăng tốc độ phản ứng
Bài 28: Cho phương trình hoá học của phản ứng tổng hợp amoniac:
N2(k) + 3H2(k) ![]() 2NH3(k)
2NH3(k)
Khi tăng nồng độ của H2 lên 2 lần, tốc độ phản ứng thuận:
A. tăng lên 8 lần.
B. giảm đi 2 lần.
C. tăng lên 6 lần.
D. tăng lên 2 lần.
Đáp án: A
Giải thích:
V = k. [N2 ] . [H2]3
Khi tăng nồng độ H2 lên 2 lần thì Vận tốc tăng lên 23 = 8 lần
Bài 29: Khi nhiệt độ tăng lên 100C, tốc độ của một phản ứng hoá học tăng lên 3 lần. Người ta nói rằng tốc độ phản ứng hoá học trên có hệ số nhiệt độ bằng 3. Điều khẳng định nào sau đây là đúng?
A. Tốc độ phản ứng tăng lên 256 lần khi nhiệt độ tăng từ 20oC lên 50oC.
B. Tốc độ phản ứng tăng lên 243 lần khi nhiệt độ tăng từ 20oC lên 50oC.
C. Tốc độ phản ứng tăng lên 27 lần khi nhiệt độ tăng từ 20oC lên 50oC.
D. Tốc độ phản ứng tăng lên 81 lần khi nhiệt độ tăng từ 20oC lên 50oC.
Đáp án: C
Giải thích:
Tốc độ sẽ tăng lên ![]() = 33 = 27 lần
= 33 = 27 lần
Bài 30: Cho phản ứng: 2 SO2 + O2 ⇄ 2SO3
Tốc độ phản ứng tăng lên 4 lần khi:
A. Tăng nồng độ SO2 lên 2 lần
B.Tăng nồng độ SO2 lên 4 lần
C. Tăng nồng độ O2 lên 2 lần
D. Tăng đồng thời nồng độ SO2 và O2 lên 2 lần
Đáp án: A
Giải thích:
V = k . [SO2]2 . [O2]
V tăng lên 4 lần → nồng độ của SO2 tăng lên 2 lần hoặc nồng dộ của O2 tăng lên 4 lần
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.