Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Định luật tuần hoàn
Nội dung của định luật tuần hoàn: “Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử”.
II. Ý nghĩa của bảng tuần hoàn
Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron nguyên tử, từ đó dự đoán được tính chất hóa học của các nguyên tố.
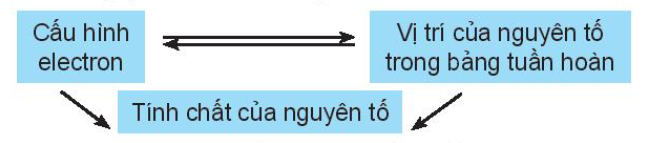
Chú ý: Từ vị trí của nguyên tố trong bảng tuần hoàn, có thể:
- Viết được cấu hình electron của nguyên tử và ngược lại.
- Dự đoán được tính chất (tính kim loại, tính phi kim) của nguyên tố đó.
- Viết được công thức oxide, hydroxide và nêu tính acid, base tương ứng.
Ví dụ 1: Nguyên tố chlorine (Cl) ở ô số 17, nhóm VIIA, chu kì 3.
- Nguyên tử Cl có:
+ 17 proton, 17 electron (do số proton = số electron = Z).
+ 3 lớp electron (do số lớp electron = số thứ tự chu kì).
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng = số thứ tự nhóm A).
Cấu hình electron của Cl: 1s22s22p63s23p5. Cl là nguyên tố phi kim. Oxide cao nhất (Cl2O7) là acidic oxide và acid tương ứng HClO4 là acid mạnh.
Ví dụ 2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
- Nguyên tử P có Z = 15 (do số proton = số electron = Z).
- Nguyên tố P ở chu kì 3, nhóm VA (do có 3 lớp electron và có 5 electron ở lớp ngoài cùng).
- P là nguyên tố phi kim. Oxide cao nhất (P2O5) là acidic oxide và acid tương ứng là (HPO3 hay H3PO4) là acid trung bình.
Ví dụ 3: So sánh tính phi kim của P (Z = 15), O (Z = 8) và S (Z = 16).
P (Z = 15): 1s22s22p63s23p3 → Nguyên tố P thuộc chu kì 3, nhóm VA.
O (Z = 8): 1s22s22p4 → Nguyên tố O thuộc chu kì 2, nhóm VIA.
S (Z = 16): 1s22s22p63s23p4 → Nguyên tố S thuộc chu kì 3, nhóm VIA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần → Tính phi kim: P < S.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần → Tính phi kim: S < O.
Vậy tính phi kim: P < S < O.
Bài tập
Câu 1. Theo định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất biển đổi như thế nào theo chiều tăng của điện tích hạt nhân?
A. Không theo quy luật.
B. Tuần hoàn.
C. Chỉ tuần hoàn trong một nhóm.
D. Chỉ tuần hoàn trong một chu kì.
Đáp án: B
Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất biển đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
Câu 2. Nguyên tử của nguyên tố chlorine có Z = 17. Hydroxide cao nhất của nguyên tố này có
A. tính axit mạnh.
B. tính axit yếu.
C. tính base mạnh.
D. tính base yếu.
Đáp án: C
Cấu hình electron của nguyên tử nguyên tố chlorine (Cl):1s22s22p63s23p5.
→ Nguyên tố Cl nằm ở ô 17, chu kì 3, nhóm VIIA của bảng tuần hoàn.
→ Hóa trị cao nhất của nguyên tố Cl là VII.
→ Công thức hydroxide của Cl là HClO4 (có tính axit mạnh).
Câu 3. Nguyên tố X có Z = 19. Công thức oxide và hydroxide cao nhất của X lần lượt là
A. Na2O, NaOH.
B. SO3; H2SO4.
C. K2O; KOH.
D. KO, K(OH)2.
Đáp án: C
Cấu hình electron nguyên tử của X (Z = 19): 1s22s22p63s23p64s1.
→ X là nguyên tố potassium (K), nằm ở ô 19, chu kì 3, nhóm IA.
→ Hóa trị cao nhất của nguyên tố X là I.
Công thức oxide cao nhất là K2O; công thức hydroxide cao nhất là KOH.
Câu 4. Nguyên tố X có Z = 9. Hãy có biết tính chất hóa học cơ bản của X (X là kim loại hay phi kim, mạnh hay yếu)?
A. Tính phi kim yếu.
B. Tính kim loại yếu.
C. Tính phi kim mạnh.
D. Tính kim loại mạnh.
Đáp án: C
Cấu hình electron nguyên tử của X (Z = 9): 1s22s22p5.
→ X là nguyên tố Fluorine (F), nằm ở ô 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn.
→ Fluorine có tính phi kim mạnh.
Câu 5. Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì
A. phi kim mạnh nhất là fluorine.
B. phi kim mạnh nhất là bromine.
C. kim loại mạnh nhất là lithium.
D. kim loại yếu nhất là caesium.
Đáp án: A
Theo quy luật biến đổi tính kim loại, tính phi kim của các nguyên tố:
Kim loại mạnh nhất nằm ở cuối nhóm IA → Caesium (Cs) là kim loại mạnh nhất (vì Francium là nguyên tố phóng xạ).
Phi kim mạnh nhất nằm ở đầu nhóm VIIA → Fluorine (F) là phi kim mạnh nhất.
Câu 6. Nguyên tố neon có Z = 10. Cấu hình electron nguyên tử của neon là
A. 1s22s22p5.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p63s2.
Đáp án: B
Cấu hình electron nguyên tử của neon (Z = 10): 1s22s22p6.
Câu 7. Nguyên tử zinc có Z = 30. Vị trí của nguyên tố Zinc trong bảng tuần hoàn là
A. ô 30, chu kì 4, nhóm VIIIB.
B. ô 30, chu kì 4, nhóm IIB.
C. ô 30, chu kì 3, nhóm VIIIB.
D. ô 30, chu kì 3, nhóm IIB.
Đáp án: B
Cấu hình elecctron nguyên tử của zinc (Z = 30): 1s22s22p63s23p63d104s2.
Số thứ tự ô = Z = 30.
Số thứ tự chu kì = số lớp e = 4 → Chu kì 4.
Cấu hình electron phân lớp ngoài cùng và sát ngoài cùng là 3d104s2.
Tổng số electron thuộc 2 phân lớp 3d và 4s là 12 → Zinc thuộc nhóm IIB.
Vậy: Nguyên tố zinc nằm ở ô 30, chu kì 4, nhóm IIB trong bảng tuần hoàn.
Câu 8. Nguyên tố sodium thuộc chu kì 3, nhóm IA. Khi tham gia phản ứng hóa học, sodium dễ
A. nhận 1 electron.
B. nhường 1 electron.
C. nhận 2 electron.
D. nhường 2 electron.
Đáp án: B
Số lớp electron = số thứ tự chu kì = 3.
Số electron lớp ngoài cùng = số thứ tự nhóm A = 1.
→ Cấu hình electron nguyên tử của sodium: 1s22s22p63s1.
→ Khi tham gia phản ứng hóa học, sodium dễ nhường 1 electron ở lớp ngoài cùng để đạt cấu hình electron bền vững: Na → Na+ + 1e.
Câu 9. Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của nguyên tố R trong bảng tuần hoàn là:
A. ô 18, chu kì 3, nhóm IIA.
B. ô 19, chu kì 4, nhóm IIA.
C. ô 18, chu kì 3, nhóm VIIIA.
D. ô 19, chu kì 4, nhóm IA.
Đáp án: D
Cấu hình electron của R+ : 1s22s22p23s23p6.
Nguyên tử R nhường 1 electron để trở thành cation R+:
R → R+ + 1e.
→ Cấu hình electron của nguyên tử R: 1s22s22p63s23p64s1.
→ Nguyên tố R nằm ở ô 19, chu kì 4, nhóm IA.
Câu 10. Anion X- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Nguyên tố X là
A. chlorine.
B. fluorine.
C. sodium.
D. potassium.
Đáp án: A
Cấu hình electron của X- : 1s22s22p63s23p6.
Nguyên tử X nhận 1 electron để trở thành anion X-:
X + 1e → X-.
→ Cấu hình electron của nguyên tử X: 1s22s22p63s23p5 (Z = 17).
→ X là nguyên tố chlorine (Cl).
Câu 11. Hydroxide của nguyên tố M có tính base rất mạnh. Biết rằng hydroxide của M tác dụng với dung dịch HCl theo tỉ lệ mol 1 : 1. Hãy dự đoán nguyên tố M thuộc nhóm nào trong bảng tuần hoàn các nguyên tố hóa học.
A. IIA.
B. IIIA.
C. VA.
D. IA.
Đáp án: D
Hydroxide của M tác dụng với dung dịch HCl theo tỉ lệ mol 1 : 1.
→ Công thức hydroxide của M là MOH.
MOH + HCl → MCl + H2O
Hóa trị của nguyên tố M cao nhất là I.
→ M thuộc nhóm IA.
Câu 12. Oxide cao nhất của nguyên tố X khi tan trong nước tạo dung dịch làm giấy quỳ tím chuyển sang màu xanh. Biết phần trăm khối lượng của X trong oxide này là 74,19%. Phát biểu nào sau đây không đúng?
A. X là nguyên tố kim loại.
B. Công thức hydroxide cao nhất của X là NaOH.
C. X thuộc nhóm IIA.
D. Cấu hình electron lớp ngoài cùng của X có dạng ns1.
Đáp án: C
Oxide cao nhất của nguyên tố X khi tan trong nước tạo dung dịch làm giấy quỳ tím chuyển sang màu xanh.
→ X là nguyên tố kim loại.
Gọi hóa trị cao nhất của X là n.
→ Công thức oxide cao nhất của X có dạng: X2On.
Ta có: ![]()
Chọn n = 1 → MX = 23 → X là nguyên tố sodium (Na).
Vậy:
+ X có hóa trị cao nhất là I → X thuộc nhóm IA.
+ Cấu hình electron lớp ngoài cùng của X có dạng ns1.
+ Công thức hydroxide cao nhất của X là NaOH.
Câu 13. Cho 4,8 gam kim loại M thuộc nhóm IIA tác dụng với lượng dư dung dịch HCl, thu được 4,48 lít khí H2 (đktc). Kim loại M là
A. Ca.
B. Zn.
C. Mg.
D. Ba.
Đáp án: C
M thuộc nhóm IIA → M có hóa trị II.
Phương trình hóa học:
M + 2HCl → MCl2 + H2.
nM = nH2 = 0,2 (mol).
→ MM = ![]() = 24 (amu)
= 24 (amu)
→ M là nguyên tố magnesium (Mg).
Câu 14. A và B là hai nguyên tố trong cùng một nhóm và ở hai chu kì liên tiếp của bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tử A và B bằng 30. Hai nguyên tố đó là
A. Ca và Mg.
B. K và Rb.
C. Na và K.
D. O và S.
Đáp án: C
Gọi số hiệu nguyên tử của nguyên tố A và B lần lượt là ZA, ZB (Giả sử ZA > ZB).
Tổng số proton trong hạt nhân của hai nguyên tử A và B bằng 30.
→ ZA + ZB = 30 (*).
Nhận xét: 4 < ZA + ZB < 32 → ZA – ZB = 8 (**).
Từ (*) và (**), suy ra: ZA = 19; ZB = 11.
→ A là nguyên tố potassium (K); B là nguyên tố sodium (Na).
Câu 15. A và B là hai nguyên tố trong cùng một chu kì và ở hai nhóm liên tiếp của bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tử A và B bằng 15. Hai nguyên tố đó là
A. C và N.
B. N và O.
C. P và S.
D. Na và Mg.
Đáp án: B
Gọi số hiệu nguyên tử của nguyên tố A và B lần lượt là ZA, ZB (giả sử ZA < ZB).
Tổng số proton trong hạt nhân của hai nguyên tử A và B bằng 15.
→ ZA + ZB = 15 (*).
A và B là hai nguyên tố trong cùng một chu kì và ở hai nhóm liên tiếp của bảng tuần hoàn.
→ ZB – ZA = 1 (**).
Từ (*) và (**), suy ra: ZA = 7; ZB = 8.
→ A là nguyên tố nitrogen (N); B là nguyên tố oxygen (O).
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.