Với giải Câu hỏi 4 trang 37 Hóa học 11 Kết nối tri thức chi tiết trong Bài 5: Ammonia. Muối ammonium giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập Hoá học 11. Mời các bạn đón xem:
So sánh phân tử ammonia và ion ammonium
Câu hỏi 4 trang 37 Hóa học 11: a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hoá trị, số oxi hoá của nguyên tử nitrogen.
b) Viết phương trình hoá học minh hoạ tính acid/base của ammonia và ammonium.
Lời giải:
a)
|
Phân tử/ Ion |
Dạng hình học |
Số liên kết cộng hoá trị của nitrogen |
Số oxi hoá của nitrogen |
|
Ammonia (NH3) |
Chóp tam giác |
3 |
-3 |
|
Ammonium (NH4+) |
Tứ diện
|
4 |
-3 |
b)
- NH3 có tính base. Một số phương trình hoá học minh hoạ:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4.
- NH4+ có tính acid. Một số phương trình hoá học minh hoạ:
NH4NO3 + NaOH 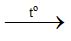 NaNO3 + NH3 + H2O
NaNO3 + NH3 + H2O
NH4Cl + NaOH 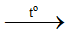 NaCl + NH3 + H2O
NaCl + NH3 + H2O
Phương trình ion rút gọn:
NH4+ + OH− → NH3 + H2O.
Xem thêm các bài giải Hoá học 11 Kết nối tri thức hay, chi tiết khác:
Mở đầu trang 33 Hóa học 11: Từ ammonia, thông qua phản ứng nào có thể sản xuất...
Hoạt động 1 trang 33 Hóa học 11: Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
Hoạt động 2 trang 33 Hóa học 11: Trình bày các bước lập công thức Lewis của phân tử ammonia.
Câu hỏi 1 trang 34 Hóa học 11: Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích...
Câu hỏi 2 trang 34 Hóa học 11: Hãy giải thích tại sao ammonia tan tốt trong nước
Hoạt động trang 34 Hóa học 11: Trong công nghiệp, phản ứng giữa ammonia với acid...
Câu hỏi 3 trang 34 Hóa học 11: Trong hai phản ứng oxi hoá ammonia bằng oxygen ở trên, hãy:
Hoạt động trang 35 Hóa học 11: Sưu tầm một số hình ảnh để báo cáo, thuyết trình về...
Hoạt động trang 35 Hóa học 11: Vận dụng kiến thức về cân bằng hoá học,...
Thí nghiệm trang 36 Hóa học 11: Nhận biết ion ammonium trong phân đạm
Câu hỏi 4 trang 37 Hóa học 11: a) So sánh phân tử ammonia và ion ammonium về dạng hình học...
Em có thể trang 37 Hóa học 11: - Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng....
Xem thêm các bài giải Hoá học 11 Kết nối tri thức hay, chi tiết khác:
Hoá học 11 ( Kết nối tri thức ) Bài 3: Ôn tập chương 1
Hoá học 11 (Kết nối tri thức) Bài 4: Nitrogen
Hoá học 11 (Kết nối tri thức) Bài 6: Một số hợp chất của nitrogen với oxygen
Hoá học 11 (Kết nối tri thức) Bài 7: Sulfur và sulfur dioxide
Hoá học 11 (Kết nối tri thức) Bài 8: Sulfuric acid và muối sulfate
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.