Toptailieu.vn xin giới thiệu phương trình CH3CH(NH2)COOH + NaOH → CH3CH(NH2)COONa + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình CH3CH(NH2)COOH + NaOH → CH3CH(NH2)COONa + H2O
1. Phản ứng hóa học:
CH3CH(NH2)COOH + NaOH → CH3CH(NH2)COONa + H2O
2. Điều kiện phản ứng
- Phản ứng xảy ra ở điều kiện thường.
3. Cách thực hiện phản ứng
- Nhỏ từ từ alanin 10% vào ống nghiệm chứa 1 ml NaOH 10% và 1 giọt phenol phatalein.
4. Hiện tượng nhận biết phản ứng
- Ban đầu ống nghiệm đựng NaOH và phenolphtalein có màu hồng, sau khi nhỏ alanin màu của dung dịch trong ống nghiệm thay đổi.
5. Tính chất hóa học
5.1. Tính chất hóa học của CH3CH(NH2)COOH (Alanin)
a. Tác dụng với dung dịch bazơ (do có nhóm COOH):
CH3CH(NH2)COOH + NaOH → CH3CH(NH2)COONa + H2O
b. Tác dụng với dung dịch axit (do có nhóm NH2):
CH3CH(NH2)COOH + HCl → ClH3N-CH2-COOH
c. Phản ứng este hóa nhóm COOH :
CH3CH(NH2)COOH + C2H5OH 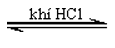
5.2. Tính chất hóa học của NaOH
a. Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
b. Natri hidroxit tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2...
Ví dụ:
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
e. Natri hidroxit tác dụng với một số phi kim
Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
Dung dịch NaOH có khả năng hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
6. Bạn có biết
- Phản ứng trên cho thấy alanin có chứa nhóm chức axit.
- Các amino axit khác cũng có phản ứng với NaOH tương tự alanin.
7. Bài tập liên quan
Ví dụ 1: Dãy gồm các chất đều phản ứng với NaOH là
A. anilin, etylamin.
B. alanin, etylamin.
C. alanin, amoniac.
D. alanin, glyxin.
Hướng dẫn: alanin, glyxin là các amino axit nên đều phản ứng với NaOH.
Đáp án: D
Ví dụ 2: Khối lượng alanin cần dung để phản ứng vừa đủ với 0,1 mol NaOH là
A. 8,9g. B. 8,0g.
C. 8,5g. D. 9,0g.
Hướng dẫn:
CH3CH(NH2)COOH (0,1 mol) + NaOH (0,1 mol) → CH3CH(NH2)COONa (0,1 mol) + H2O
m = 0,1. 89 = 8,9 gam.
Đáp án: A
Ví dụ 3: Cho 1,78 gam alanin phản ứng vừa đủ với NaOH thu được muối có khối lượng là
A. 1,72g. B. 1,82g.
C. 1,92g. D. 2,22g.
Hướng dẫn:
CH3CH(NH2)COOH (0,02 mol) + NaOH → CH3CH(NH2)COONa (0,02 mol) + H2O
m = 0,02.111 = 2,22 gam.
Đáp án: D
8. Một số phương trình phản ứng hoá học khác của Amino Axit và hợp chất
Xem thêm các bài phương trình hóa học khác tại đây:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.