Toptailieu.vn biên soạn và giới thiệu Công thức electron của CH4 chương trình mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững Công thức electron của CH4 gặp từ đó học tốt môn Hóa học.
Nội dung bài viết
Công thức electron của CH4 chương trình mới
1. Công thức electron của CH4
- Sự tạo thành phân tử CH4: Nguyên tử hydrogen (H) có cấu hình electron là 1s1, nguyên tử carbon (C) có cấu hình electron là 1s22s22p2. Để đạt được cấu hình electron bền vững của khí hiếm gần nhất, nguyên tử C cần thêm 4 electron, mỗi nguyên tử H cần thêm 1 electron. Khi hình thành phân tử CH4, mỗi nguyên tử H góp chung 1 electron với nguyên tử C, 4 nguyên tử H sẽ tạo thành 4 cặp electron dùng chung với nguyên tử C.
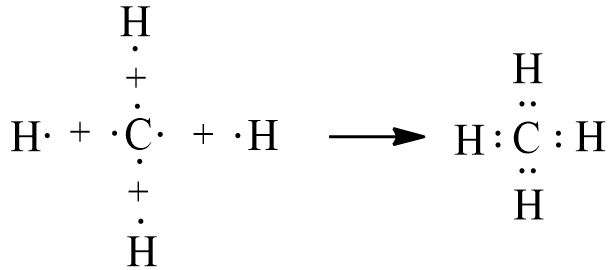
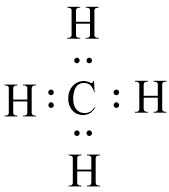
- Công thức electron của CH4 là:
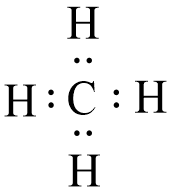
- Nhận xét:
+ Phân tử CH4 có 4 cặp electron dùng chung. Cặp electron chung không bị lệch về phía nguyên tử nào.
+ Trong phân tử CH4 không có electron tự do.
2. Công thức Lewis của CH4
a) Cách 1: Viết công thức Lewis dựa vào công thức electron
Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của CH4 ta thấy mỗi nguyên tử H liên kết với nguyên tử C bằng 1 cặp electron, ta thay mỗi cặp electron này bằng một gạch nối “–”. Ta được công thức Lewis của CH4 là:
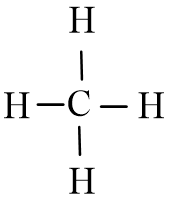
b) Cách 2: Thực hiện lần lượt theo các bước sau
Bước 1: Tính tổng số electron hóa trị trong phân tử
Carbon (C) có 4 electron hóa trị, hydrogen có 1 electron hóa trị. Trong phân tử CH4 có 1 nguyên tử C và 4 nguyên tử H.
Vậy tổng số electron hóa trị = 4 + 4.1 = 8 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
Trong phân tử CH4, nguyên tử C cần 4 electron để đạt octet, mỗi nguyên tử H cần 1 electron để đạt octet. Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
 (1)
(1)
Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 8 – 2.4 = 0
Từ công thức (1), nguyên tử H và C đều đã đủ octet.
Vậy công thức Lewis của CH4 là:
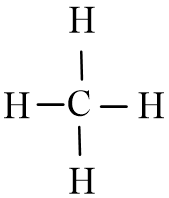
- Nhận xét:
+ ∆χ(C – H) = |2,55 – 2,2| = 0,35 < 0,4 ⇒ Liên kết trong phân tử CH4 thuộc loại liên kết cộng hóa trị không phân cực.
+ Liên kết C – H được tạo thành do sự xen phủ orbital s – p.
+ Phân tử CH4 có dạng tứ diện đều.
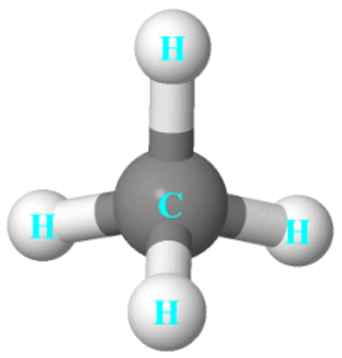
3. Cách viết công thức cấu tạo
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
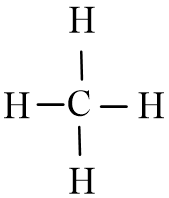
- Công thức cấu tạo của CH4 là:
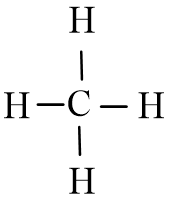
- Nhận xét:
+ Trong phân tử CH4 có 4 liên kết đơn C – H.
+ Công thức Lewis của CH4 trùng với công thức cấu tạo do các nguyên tử đều không còn electron riêng.
4. Bài tập mở rộng về CH4
Câu 1. Liên kết nào dưới đây là liên kết cộng hóa trị không phân cực?
A. Na – O
B. O – H
C. Na – C
D. C – H
Hướng dẫn giải
Đáp án đúng là: D
Liên kết C – H có hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là
|3,16 – 2,96| = 0,2 < 0,4 nên là liên kết cộng hóa trị không phân cực.
Câu 2. Trong phân tử methane (CH4) số cặp electron chung giữa nguyên tử carbon (C) và các nguyên tử hydrogen (H) là
A. 3
B. 2
C. 1
D. 4
Hướng dẫn giải
Đáp án đúng là: D
Nguyên tử hydrogen (H) có cấu hình electron là 1s1, nguyên tử carbon (C) có cấu hình electron là 1s22s22p2. Để đạt được cấu hình electron bền vững của khí hiếm gần nhất, nguyên tử C cần thêm 4 electron, mỗi nguyên tử H cần thêm 1 electron. Khi hình thành phân tử CH4, mỗi nguyên tử H góp chung 1 electron với nguyên tử C, 4 nguyên tử H sẽ tạo thành 4 cặp electron dùng chung với nguyên tử C.
Xem thêm các bài giải Cấu hình electron của các nguyên tố chương trình mới hay, chi tiết khác:
Cách viết công thức electron chương trình mới
Công thức electron của H2 chương trình mới
Công thức electron của F2 chương trình mới
Công thức electron của H2S chương trình mới
Công thức electron của CH4 chương trình mới
Công thức electron của SO2 chương trình mới
Công thức electron của CO chương trình mới
Công thức electron của SO3 chương trình mới
Công thức electron của HNO3 chương trình mới
Công thức electron của C2H2 chương trình mới
Công thức electron của C2H4 chương trình mới
Công thức electron của HOCl chương trình mới
Công thức electron của HCN chương trình mới
Công thức electron của PH3 chương trình mới
Công thức electron của CF4 chương trình mới
Công thức electron của F2O chương trình mới
Công thức electron của C2H6 chương trình mới
Công thức electron của CHCl3 chương trình mới
Công thức electron của PCl3 chương trình mới
Công thức electron của CO2 chương trình mới
Công thức electron của CS2 chương trình mới
Công thức electron của NH3 chương trình mới
Công thức electron của H2O chương trình mới
Công thức electron của HCl chương trình mới
Công thức electron của N2 chương trình mới
Công thức electron của O2 chương trình mới
Công thức electron của Cl2 chương trình mới
Công thức electron của BF3 chương trình mới
Công thức electron của SCl2 chương trình mới
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.