Toptailieu.vn xin giới thiệu phương trình (C15H31COO)3C3H5 + 3H2O ⇋ 3C15H31COOH + C3H5(OH)3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình (C15H31COO)3C3H5 + 3H2O ⇋ 3C15H31COOH + C3H5(OH)3
1. Phản ứng hóa học:
(C15H31COO)3C3H5 + 3H2O 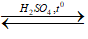
2. Điều kiện phản ứng
- Đun sôi nhẹ trong môi trường axit.
3. Cách thực hiện phản ứng
- Cho 2g Tripanmitin vào ống nghiệm, sau đó cho tiếp dung dịch 1 ml H2SO4 20%. Lắc đều ống nghiệm rồi đun cách thủy trong 5 phút.
4. Hiện tượng nhận biết phản ứng
- Sản phẩm sinh hòa tan Cu(OH)2 tạo phức màu xanh đặc trưng.
5. Tính chất hóa học
5.1. Tính chất hóa học của (C15H31COO)3C3H5
a. Phản ứng thủy phân trong mỗi trường axit
(C15H31COO)3C3H5 + 3H2O 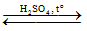
b. Phản ứng thủy phân trong mỗi trường kiềm (xà phòng hóa)
(C15H31COO)3C3H5 + 3NaOH 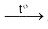
5.2. Tính chất hóa học của H2O
a. Nước tác dụng với kim loại
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịc bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
6. Bạn có biết
- Phản ứng trên gọi là phản ứng thủy phân este trong môi trường axit.
- Các este khác cũng có phản ứng thủy phân trong môi trường axit tương tự tripanmitin
7. Bài tập liên quan
Ví dụ 1: Phản ứng thủy phân tripanmitin trong môi trường axit là
A. (C15H31COO)3C3H5 + 3NaOH 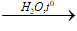
B. (C17H33COO)3C3H5 + 3H2O 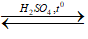
C. (C15H31COO)3C3H5 + 3H2O 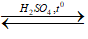
D. C2H5COOH + CH3OH 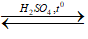
Hướng dẫn:
(C15H31COO)3C3H5 + 3H2O 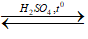
Đáp án C.
Ví dụ 2: Nhận biết C3H5(OH)3 có trong sản phẩm thu được sau phản ứng bằng cách
A. Sử dụng quỳ tím ẩm.
B. Sử dụng dung dịch brom.
C. Sử dụng bột sắt.
D. Sử dụng đồng hidroxit.
Hướng dẫn:
C3H5(OH)3 tác dụng với đồng hidroxit tạo phức màu xanh đặc trưng
Đáp án D.
Ví dụ 3: Khi thủy phân tripanmitin trong môi trường axit, chất sau phản ứng không có
A. Ancol đa chức.
B. Axit đa chức.
C. Este tripanmitin.
D. Axit panmitic..
Hướng dẫn: Sau phản ứng thu được axit panmitic là axit đơn chức.
Đáp án A.
8. Một số phương trình phản ứng hoá học khác của Este và hợp chất:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.