Toptailieu.vn giới thiệu phương trình 3C2H5NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C2H5NH3Cl gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Nội dung bài viết
Phương trình 3C2H5NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C2H5NH3Cl
1. Phản ứng hóa học:
3C2H5NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C2H5NH3Cl
2. Điều kiện phản ứng
- Phản ứng xảy ra ở điều kiện thường.
3. Cách thực hiện phản ứng
- Cho etylamin phản ứng với muối sắt III clorua.
4. Hiện tượng nhận biết phản ứng
- Sau phản ứng thấy xuất hiện kết tủa màu nâu đỏ.
5. Tính chất hóa học
5.1. Tính chất hóa học của C2H5NH2
a. Tính bazơ :
- Dung dịch Etylamin có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do kết hợp với proton mạnh hơn amoniac
- Amin có tính bazo yếu nên có thể phản ứng với các axit vô cơ để tạo thành muối
C2H5NH2 + HCl → C2H5NH3Cl
b. Phản ứng với axit nitrơ :
C2H5NH2 + HONO → C2H5OH + N2 + H2O
c. Phản ứng ankyl hóa :
C2H5NH2 + CH3I 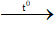
d. Phản ứng với dung dịch muối của các kim loại có hiđroxit kết tủa :
3C2H5NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C2H5NH3Cl
e. Phản ứng đốt cháy
4C2H7N + 15O2 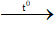
5.2. Tính chất hóa học của FeCl3
- Tính chất hóa học của muối:
- Có tính oxi hóa: Khi tác dụng với chất khử, hợp chất sắt (III) clorua bị khử thành hợp chất sắt (II) hoặc kim loại sắt tự do.
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
a. Tính chất hóa học của muối:
- Tác dụng với dung dịch kiềm:
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
- Tác dụng với muối
FeCl3 + 3AgNO3 → Fe(NO3)3 + 3AgCl
- Tác dụng với dung dịch axit:
- Sục khí H2S vào dung dịch FeCl3 có hiện tượng vẫn đục:
2FeCl3 + H2S → 2 FeCl2 + 2 HCl + S
b. Tính oxi hóa
Fe + 2FeCl3 → 3FeCl2
Cu + 2FeCl3 → 2FeCl2 + CuCl2
5.3. Tính chất hóa học của H2O
a. Nước tác dụng với kim loại
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịc bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
6. Bạn có biết
- Etylamin có thể phản ứng với các dung dịch muối của các kim loại có hidroxit kết tủa.
7. Bài tập liên quan
Ví dụ 1: Chất phản ứng với dung dịch FeCl3 cho kết tủa là
A. C2H5NH2. B. C2H5COOC2H5.
C. C2H5OH. D. C2H5COOH.
Hướng dẫn:
etylamin phản ứng với dung dịch FeCl3 cho kết tủa.
Đáp án: A
Ví dụ 2: Chất nào sau đây phản ứng với C2H5NH2 tạo kết tủa?
A. NaCl. B. HNO2. `
C. MgCl2. D. NaOH.
Hướng dẫn:
2C2H5NH2 + MgCl2 + 2H2O → Mg(OH)2 + 2C2H5NH3Cl
Đáp án: C
Ví dụ 3: Phản ứng nào sau đây là sai?
A. C2H5NH2 + HCl → C2H5NH3Cl
B. C2H5NH2 + HONO → C2H5OH + N2 + H2O
C. C2H5NH2 + NaCl + H2O → NaOH + C2H5NH3Cl
D. 3C2H5NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C2H5NH3Cl
Hướng dẫn:
NaOH là bazo tan, nên phản ứng không xảy ra.
Đáp án: C
8. Một số phương trình phản ứng hoá học khác của Amin và hợp chất:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.