Toptailieu.vn xin giới thiệu phương trình 3C4H8+ 4H2O + 2KMnO4 → 3C4H8(OH)2 + 2MnO2 + 2KOH gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình 3C4H8+ 4H2O + 2KMnO4 → 3C4H8(OH)2 + 2MnO2 + 2KOH
1. Phản ứng hóa học:
3C4H8 + 4H2O + 2KMnO4 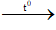
2. Điều kiện phản ứng
- Phản ứng xảy ra ngay ở điều kiện thường.
3. Cách thực hiện phản ứng
- Sục khí buten vào dung dịch thuốc tím (KMnO4), thấy màu của dung dịch thuốc tím nhạt dần và có kết tủa màu nâu đen của MnO2.
4. Hiện tượng nhận biết phản ứng
- Màu của dung dịch thuốc tím nhạt dần và có kết tủa màu nâu đen của MnO2.
5. Tính chất hóa học
5.1. Tính chất hóc học của C4H8
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
+ Phản ứng cộng axit hoặc nước vào buten không đối xứng thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
b. Phản ứng trùng hợp
- Buten trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Buten cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C4H8 + 6O2 → 4CO2 + 4H2O
- Buten làm mất màu dung dịch KMnO4:
C4H8 + 4KMnO4 + 2H2O → 4KOH + 4MnO2 + 3C4H8(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
5.2. Tính chất hóa học của KMnO4
Vì là chất oxi hóa mạnh nên KMnO4 có thể phản ứng với kim loại hoạt động mạnh, axit hay các hợp chất hữu cơ dễ dàng.
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
KMnO4 có thể phản ứng với nhiều axit mạnh như H2SO4, HCl hay HNO3, các phương trình phản ứng minh họa gồm:
Thuốc tím có thể tác dụng với nhiều dung dịch kiềm hoạt động mạnh như KOH, NaOH, phương trình phản ứng minh họa:
Vì thuốc tím là chất oxy hóa mạnh nên có thể phản ứng với nhiều loại dung dịch và cho ra nhiều sản phẩm khác nhau.
Trong môi trường axit, mangan bị khử thành Mn2+
Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
Trong môi trường kiềm, bị khử thành MnO42-
Phản ứng với etanol
Phản ứng với axetilen trong môi trường kiềm:
Phản ứng với axetilen trong môi trường trung tính:
Phản ứng với axetilen trong môi trường axit
KMnO4 phản ứng với Ethylene trong môi trường kiềm:
KMnO4 phản ứng với Ethylene trong môi trường trung tính
Phản ứng với glycerol
Thuốc tím tác dụng với H2O2
KMnO4 tác dụng với H2S
6. Bạn có biết
- Phản ứng trên gọi là phản ứng oxi hóa không hoàn toàn.
- Phản ứng này dung để phân biệt anken và ankan.
7. Bài tập liên quan
Ví dụ 1: Để làm sạch butan có lẫn buten ta có thể cho hỗn hợp đi qua lượng dư dung dịch nào sau đây?
A. NaOH.
B. KMnO4.
C. AgNO3 / NH3.
D. Cả A, B, và C.
Hướng dẫn
KMnO4 phản ứng với etilen còn etan không phản ứng.
Đáp án B.
Ví dụ 2: Anken A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,607 MA. CTPT của A là:
A. C2H4
B. C3H6
C. C4H8
D. C5H10
Hướng dẫn
anken có CTPT là CnH2n thì điol thu được có công thức CnH2n(OH)2
→ 14n + 34 = 1,607 . 14n
→ n = 34
Đáp án B.
Ví dụ 3: Thổi 0,3 mol khí propilen qua Vml dung dịch KMnO4 1M trong môi trường trung tính, phản ứng xảy ra hoàn toàn. Giá trị của V là:
A. 100 ml.
B. 200 mlg.
C. 300 ml.
D. 250 ml.
Hướng dẫn:
nKMnO4 = 0,2 mol → V = 0,2 lít
Đáp án B.
8. Một số phương trình phản ứng hóa học khác của Anken và hợp chất
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.