Toptailieu.vn biên soạn và giới thiệu lời giải Hoá học 11 (Chân trời sáng tạo) Bài 2: Cân bằng trong dung dịch nước hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu SGK Hóa học 11 Bài 2 từ đó học tốt môn Hóa học 11.
Hoá học 11 (Chân trời sáng tạo) Bài 2: Cân bằng trong dung dịch nước
Giải Hóa 11 trang 12

Lời giải:
- Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
- Để xác định nồng độ của dung dịch acid, base có thể dùng phương pháp chuẩn độ acid – base.
1. Sự điện li, chất điện li, chất không điện li
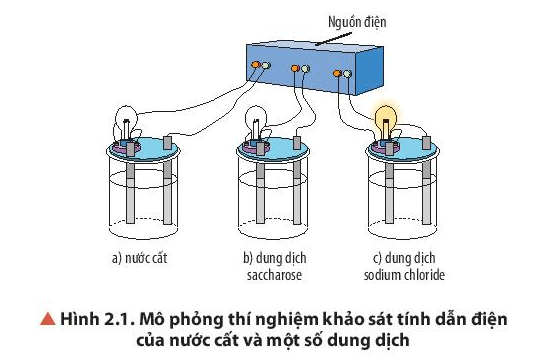
Lời giải:
Hiện tượng: Bóng đèn ở cốc đựng dung dịch sodium chloride sáng, còn bóng đèn ở cốc đựng nước cất và dung dịch saccharose không sáng.
⇒ Dung dịch sodium chloride dẫn điện; nước cất và dung dịch saccharose không dẫn điện.
Giải Hóa 11 trang 13
Lời giải:
Dung dịch NaCl có tính dẫn điện do trong nước NaCl có thể phân li ra thành các ion.
NaCl → Na+ + Cl-.
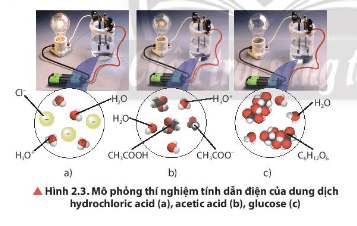
Lời giải:
- Độ sáng của bóng đèn ở các thí nghiệm giảm dần theo thứ tự: (a) > (b) > (c).
- Nhận xét:
+ Dung dịch hydrochloric acid (HCl) dẫn điện mạnh.
+ Dung dịch acetic acid (CH3COOH) dẫn điện yếu.
+ Dung dịch glucose (C6H12O6) không dẫn điện.
Lời giải:
- Phương trình (1): HCl → H+ + Cl-
⇒ HCl phân li hoàn toàn trong nước.
- Phương trình (2): CH3COOH ⇌ CH3COO- + H+
⇒ CH3COOH phân li một phần trong nước.
Giải Hóa 11 trang 14
Lời giải:
Cân bằng (2): CH3COOH ⇌ CH3COO- + H+
+ Khi thêm vài giọt dung dịch NaOH, tức thêm OH- sẽ làm giảm H+ do đó cân bằng sẽ chuyển dịch theo chiều làm tăng H+ tức chiều thuận.
+ Khi thêm vài giọt CH3COONa, tức thêm CH3COO- thì cân bằng sẽ chuyển dịch theo chiều làm giảm CH3COO- tức chiều nghịch.
Lời giải:
HNO3 → H+ + NO3-
Ca(OH)2 → Ca2+ + 2OH-
BaCl2 → Ba2+ + 2Cl-
2. Thuyết Br?nsted - Lowry về Acid - Base
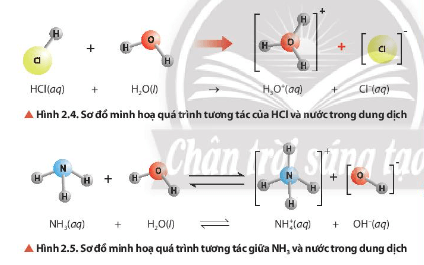
Lời giải:
Quan sát hình ảnh xác định được: NH3 nhận H+; HCl cho H+.
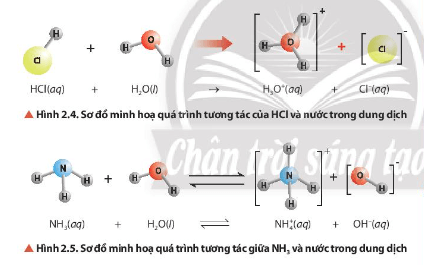
Lời giải:
- Trong cân bằng ở Hình 2.4, nước nhận H+ nên đóng vai trò là base.
- Trong cân bằng ở Hình 2.5, nước cho H+ nên đóng vai trò là acid.
- Cân bằng của ion HCO3- trong nước:
Trong cân bằng của ion HCO3- trong nước, H2O vừa nhận proton (*) vừa cho proton (**) nên là chất lưỡng tính.
Luyện tập trang 14 Hóa học 11: Cho phương trình:
(1) CH3COOH + H2O ⇌ H3O+ + CH3COO-
(2) CO32- + H2O ⇌ HCO3- + OH-
Cho biết chất nào là acid, chất nào là base theo thuyết Br?nsted – Lowry.
Lời giải:
- CH3COOH cho proton (H+) nên là acid.
- CO32- nhận proton (H+) nên là base.
3. Khái niệm pH. Chất chỉ thị Acid - Base
Giải Hóa 11 trang 15
Câu hỏi thảo luận 8 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ H+ là 10-2 M.
Lời giải:
pH = -log[H+] = -log[10-2] = 2.
Câu hỏi thảo luận 9 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ OH- là 10-4 M.
Lời giải:
Ta có: Kw = [H+].[OH-]
pH = -log[H+] = -log[10-10] = 10.
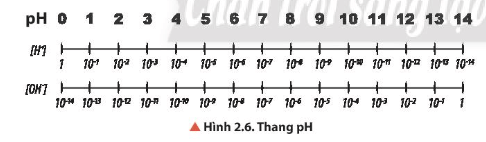
Lời giải:
- Môi trường trung tính: [H+] = [OH-] = 10-7 M hay pH = 7.
- Môi trường acid: [H+] > [OH-] hay [H+] > 10-7 M hay pH < 7.
- Môi trường base: [H+] < [OH-] hay [H+] < 10-7 M hay pH > 7.
b) Tính khối lượng NaOH cần để pha 100 mL dung dịch NaOH có pH = 12.
Lời giải:
a) HCl → H+ + Cl-
nH+ = nHCl = 0,5.0,2 = 0,1 mol.
[H+] =
pH của dung dịch thu được: pH = -log[H+] = -log[0,1] = 1.
b) NaOH → Na+ + OH-
pH = 12 Þ [H+] = 10-12 M Þ [OH-] = 10-2 M.
nOH- = 10-2.0,1 = 10-3 (mol).
Khối lượng NaOH cần dùng là: mNaOH = 10-3.40 = 0,04 gam.
Giải Hóa 11 trang 16
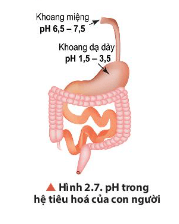
Lời giải:
- Trong khoang miệng, khoảng pH thấp nhất là 6,5; khoảng pH cao nhất là 7,5.
- Trong khoang dạ dày, khoảng pH thấp nhất là 1,5; khoảng pH cao nhất là 3,5.
Lời giải:
- Đất chua là đất dư acid, để cải thiện đất trồng bị chua người ta bón CaO do:
CaO + H2O → Ca(OH)2
Ca(OH)2 là base, sẽ trung hoà bớt acid trong đất chua, làm tăng pH của đất.
- Không bón P2O5 do: P2O5 + 3H2O → 2H3PO4.
H3PO4 là acid, càng làm tăng độ chua của đất.

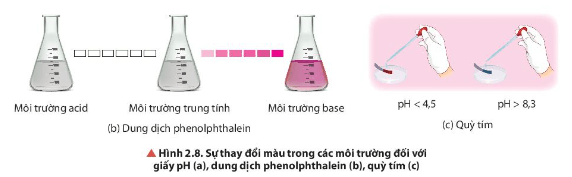
Lời giải:
- Đối với giấy pH:
+ Dung dịch có pH < 7: giấy pH có màu vàng, cam, đỏ (màu đậm nhạt khác nhau tuỳ theo pH, màu càng đậm pH càng thấp).
+ Dung dịch có pH > 7: giấy pH có màu xanh (màu đậm nhạt khác nhau tuỳ theo pH, màu càng đậm khi pH càng cao).
- Đối với phenolphthalein:
+ Môi trường acid, môi trường trung tính không làm đổi màu phenolphthalein.
+ Môi trường base làm phenolphthalein chuyển sang màu hồng.
- Đối với quỳ tím:
+ Dung dịch có pH < 4,5: quỳ tím chuyển sang màu đỏ.
+ Dung dịch có pH > 8,3: quỳ tím chuyển sang màu xanh.
4. Chuẩn độ Acid - Base
Giải Hóa 11 trang 17
Lời giải:
Vai trò của chất chỉ thị trong phương pháp chuẩn độ acid – base là để nhận biết điểm tương đương.

Lời giải:
Cần lắc nhẹ dung dịch trong bình tam giác trong khi thực hiện thao tác chuẩn độ để phản ứng xảy ra tại mọi điểm trong dung dịch.
Lời giải:
Phương trình hoá học:
NaOH + HCl → NaCl + H2O
Hay OH- + H+ → H2O.
Giải Hóa 11 trang 18
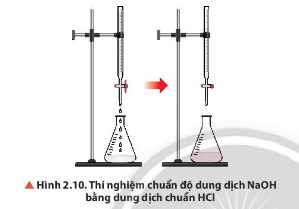
Lời giải:
Tại thời điểm kết thúc chuẩn độ dung dịch trong bình tam giác xuất hiện màu hồng nhạt bền trong khoảng 30 giây.
Lời giải:
Nồng độ của dung dịch NaOH ban đầu:
Áp dụng: CHCl.VHCl = CNaOH. VNaOH
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-
Lời giải:
Ion Al3+, Fe3+ (hay gọi chung là M3+) dễ thuỷ phân trong nước tạo thành hydroxide không tan và cho môi trường acid:
M3+ + 3H2O ⇌ M(OH)3↓ + 3H+ (*)
Trong phòng thí nghiệm người ta thường nhỏ vài giọt dung dịch acid vào trong lọ đựng dung dịch muối M3+ để bảo quản, nhằm cho cân bằng (*) chuyển dịch theo chiều nghịch, hạn chế sự thuỷ phân của muối.
Giải Hóa 11 trang 19

Lời giải:
Phèn chua hay phèn nhôm – kali có công thức: K2SO4.Al2(SO4)3.24H2O.
Khi hoà tan phèn chua trong nước phân li ra ion Al3+:
K2SO4.Al2(SO4)3.24H2O → 2K+ + 2Al3+ + 4SO42- + 24H2O.
Ion Al3+ dễ bị thuỷ phân trong nước tạo thành Al(OH)3 không tan ở dạng keo kéo theo các chất bẩn lơ lửng trong nước lắng xuống và cho môi trường acid:
Al3+ + 3H2O ⇌ Al(OH)3↓ + 3H+
⇒ H+ sinh ra phản ứng với với gỉ sét trên inox, làm sạch inox.
Lời giải:
Phương trình thuỷ phân CO32- được biểu diễn đơn giản như sau:
Quá trình thuỷ phân này sinh ra OH- làm tăng pH của nước.
Lời giải:
Vôi bột: CaO.
Vôi bột tác dụng với nước: CaO + H2O → Ca(OH)2.
Ca(OH)2 là base, sẽ trung hoà bớt acid trong nước ao, hồ, làm tăng pH của nước ao, hồ.
Bài tập (trang 19)
Lời giải:
pH = -log[H+] = 4,4.
Dung dịch có môi trường acid do pH < 7.
Lời giải:
Ta có: nHCl = 0,04.0,5 = 0,02 mol; nNaOH = 0,06.0,5 = 0,03 mol.
Phương trình hoá học:
NaOH + HCl → NaCl + H2O
0,03 0,02 mol
Theo phương trình hoá học có NaOH dư 0,01 mol;
NaOH → Na+ + OH-
[OH-] =
Lời giải:
[H+] = 10-pH = 10-2,5 = 3,16.10-3M.
Bài 4 trang 19 Hóa học 11: Viết phương trình điện li của các chất: H2SO4, Ba(OH)2, Al2(SO4)3.
Lời giải:
Phương trình điện li
H2SO4 → H+ + HSO4-
HSO4- ⇌ H+ + SO42-
Ba(OH)2 → Ba2+ + 2OH-
Al2(SO4)3 → 2Al3+ + 3SO42-
Lời giải:
Phèn chua hay phèn nhôm – kali có công thức: K2SO4.Al2(SO4)3.24H2O.
Khi hoà tan phèn chua trong nước phân li ra ion Al3+:
K2SO4.Al2(SO4)3.24H2O → 2K+ + 2Al3+ + 4SO42- + 24H2O.
Ion Al3+ dễ bị thuỷ phân trong nước tạo thành Al(OH)3 không tan ở dạng keo kéo theo các chất bẩn lơ lửng trong nước lắng xuống do đó có tác dụng làm trong nước.
Phương trình phản ứng thuỷ phân: Al3+ + 3H2O ⇌ Al(OH)3↓ + 3H+.
Trong phản ứng thuỷ phân Al3+ đóng vai trò là acid.
Xem thêm các bài giải SGK Hoá học 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hóa học
Bài 4: Ammonia và một số hợp chất ammonium
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.