Toptailieu.vn xin giới thiệu Lý thuyết Nitrogen (Kết nối tri thức) hay, chi tiết | Lý thuyết Hóa học 11. Bài viết gồm phần lý thuyết trọng tâm nhất được trình bày một cách dễ hiểu, dễ nhớ bên cạnh đó là bộ câu hỏi trắc nghiệm có hướng dẫn giải chi tiết để học sinh có thể vận dụng ngay lý thuyết, nắm bài một cách hiệu quả nhất. Mời các bạn đón xem:
Nội dung bài viết
Lý thuyết Nitrogen (Kết nối tri thức) hay, chi tiết | Lý thuyết Hóa học 11
Bài giải Bài 4: Nitrogen
A. Lý thuyết Nitrogen
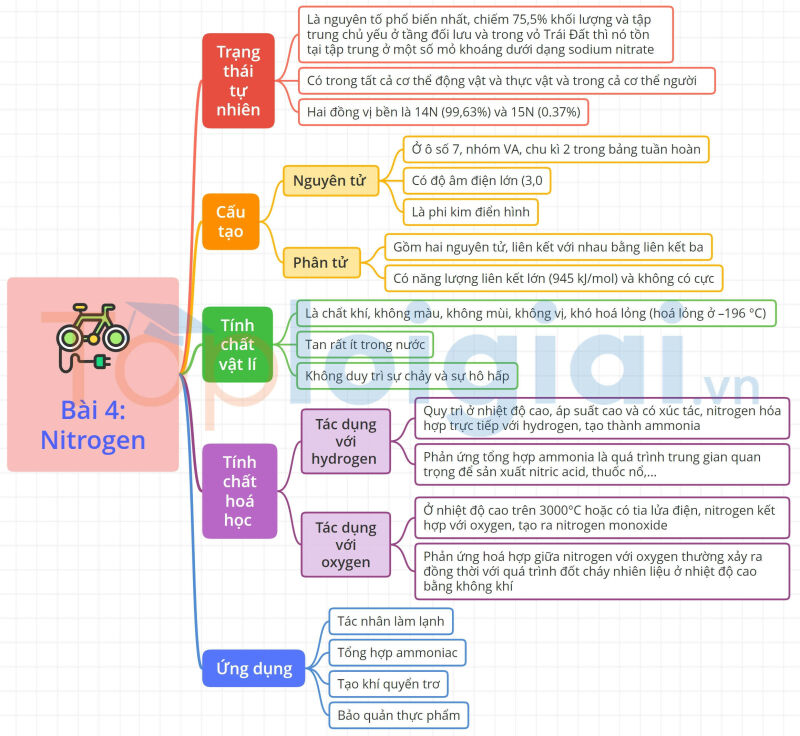
1. Trạng thái tự nhiên
Trong khí quyển Trái Đất, nitrogen là nguyên tố phổ biến nhất, chiếm 75,5% khối lượng (hoặc 78,1% thể tích ) và tập trung chủ yếu ở tầng đối lưu và trong vỏ Trái Đất thì nó tồn tại tập trung ở một số mỏ khoáng dưới dạng sodium nitrate.
Nguyên tố nitrogen có trong tất cả cơ thể động vật và thực vật và trong cả cơ thể người.
Nguyên tố nitrogen tồn tại trong tự nhiên với hai đồng vị bền là 14N (99,63%) và 15N (0.37%).
2. Cấu tạo nguyên tử, phân tử
a. Cấu tạo nguyên tử
Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn. Nguyên tử nitrogen có độ âm điện lớn (3,04). Nitrogen là phi kim điển hình.
b. Cấu tạo phân tử
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết Ϭ và 2 liên kết π). Phân tử nitrogen có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
3. Tính chất vật lí
Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hoá lỏng (hoá lỏng ở –196 °C), tan rất ít trong nước (1 lít nước hoà tan được 0,012 lit khí nitrogen). Khi nitrogen không duy trì sự chảy và sự hô hấp.
4. Tính chất hoá học
Nitrogen khá trơ ở nhiệt độ thường, ở nhiệt độ cao, nitrogen trở nên hoạt động hơn. Nitrogen thể hiện cả tính oxi hoá và tính khử.
a. Tác dụng với hydrogen
Quy trì Ở nhiệt độ cao, áp suất cao và có xúc tác, nitrogen hóa hợp trực tiếp với hydrogen, tạo thành ammonia.
Phản ứng tổng hợp ammonia là quá trình trung gian quan trọng để sản xuất nitric acid, thuốc nổ, đạm nitrate, urea, ammophos....
b. Tác dụng với oxygen
Ở nhiệt độ cao trên 3000°C hoặc có tia lửa điện, nitrogen kết hợp với oxygen, tạo ra nitrogen monoxide (NO)
N2(g) + O2(g) ⇌ 2NO(g) (điều kiện nhiệt độ)
Trong thực tế, phản ứng hoá hợp giữa nitrogen với oxygen thường xảy ra đồng thời với quá trình đốt cháy nhiên liệu ở nhiệt độ cao bằng không khi. Các hoạt động giao thông vận tải và sản xuất công nghiệp là nguyên nhân chính gây phát thải các oxide của nitrogen vào khí quyển.
5. Ứng dụng
- Tác nhân làm lạnh.
- Tổng hợp ammoniac.
- Tạo khí quyển trơ.
- Bảo quản thực phẩm.
Sơ đồ tư duy Nitrogen
B. Trắc nghiệm Nitrogen
Đang cập nhật ...
Xem thêm Lý thuyết các bài Hoá học 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Bài 5: Ammonia. Muối ammonium
Lý thuyết Bài 6: Một số hợp chất của nitrogen với oxygen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.