Với giải Bài 7.4 trang 23 SBT Hóa 11 Cánh diều chi tiết trong Bài 7: Sulfuric acid và muối sulfate giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập Hoá học 11. Mời các bạn đón xem:
Hình bên là công thức Lewis của H2SO4. a) Dựa vào công thức Lewis
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4.
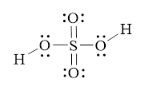
a) Dựa vào công thức Lewis của H2SO4, hãy cho biết số oxi hóa của nguyên tử sulfur trong phân tử.
b) Khi tham gia phản ứng, H2SO4 không thể tạo ra các sản phẩm chứa sulfur có số oxi hóa lớn hơn hoặc bằng 7. Giải thích.
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.
Lời giải:
a) Do 6 electron hóa trị của S bị lệch về phía các nguyên tử O nên S có số oxi hóa là +6.
b) S chỉ có 6 electron hóa trị nên không thể có số oxi hóa lớn hơn 6.
c) Có do H2SO4 cũng là chất có tính oxi hóa mạnh.
8HI + H2SO4 → H2S + 4I2 + 4H2O
Xem thêm Lời giải các bài SBT Hoá 11 Cánh Diều hay, chi tiết khác:
Bài 7.1 trang 22 SBT Hoá học 11: Những phát biểu nào sau đây là đúng?
Bài 7.2 trang 23 SBT Hoá học 11: Những đặc điểm nào sau đây về muối sulfate là đúng?
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4.
Bài 7.5 trang 23 SBT Hoá học 11: Hãy mô tả hiện tượng xảy ra và hoàn thành phương trình hoá học...
Bài 7.7 trang 24 SBT Hoá học 11: Nhiều hộ gia đình thường trữ một số hoá chất như baking soda...
Xem thêm Lời giải các bài SBT Hoá 11 Cánh Diều hay, chi tiết khác:
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 8: Hợp chất hữu cơ và hoá học hữu cơ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.