Toptailieu.vn giới thiệu Giải bài tập Hóa học 9 Bài 1: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất hóa học của oxit. Khái quát về sự phân loại oxit lớp 9.
Giải bài tập Hóa học 9 Bài 1: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
Bài tập trang 6 SGK Hóa học 9
Bài 1 trang 6 SGK Hóa học 9: Có những oxit sau: CaO, Fe2O3, SO3. Oxit nào có thể tác dụng được với
a) Nước ?
b) axit clohiđric ?
c) natri hiđroxit ?
Viết phương trình hóa học.
Phương pháp giải
Ghi nhớ:
a) Các oxit tác dụng được với nước: oxit axit và 1 số oxit bazo tan
b) Tất cả các oxit bazo đều tác dụng với axit
c) Các oxit axit tác dụng được với dd NaOH
Lời giải
a) Những oxit tác dụng với nước là CaO và SO3
CaO + H2O → Ca(OH)2
SO3 + H2O → H2SO4
b) Những oxit tác dụng với axit clohiđric là CaO và Fe2O3:
CaO + 2HCl → CaCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
c) Những oxit tác dụng với natri hiđroxit là SO3
SO3 + NaOH → NaHSO4
SO3 + 2NaOH → Na2SO4 + H2O
Bài 2 trang 6 SGK Hóa học 9: Có những chất sau: H2O, KOH, K2O, CO2. Hãy cho biết những cặp chất có thể tác dụng với nhau.Những cặp chất tác dụng được với nhau là: H2O và CO2; H2O và K2O; CO2 và K2O; CO2 và KOH.
Lời giải
H2O và CO2
H2O + CO2 → H2CO3
=> Oxit axit + H2O → Dung dịch axit
H2O và K2O
H2O + K2O → 2KOH
=> Oxit bazo + H2O → Dung dịch bazo
CO2 và K2O
CO2 + K2O → K2CO3
=> Oxit bazo + oxit axit → Muối
CO2 và KOH
CO2 + KOH → KHCO3
CO2 + 2KOH → K2CO3 + H2O
=> Bazo + oxit axit → Muối axit hoặc (Muối + H2O)
Bài 3 trang 6 SGK Hóa học 9: Từ những chất: Canxi oxit, lưu huỳnh đioxit, cacbon đioxit, lưu huỳnh trioxit, kẽm oxit, em hãy chọn chất thích hợp điền vào các sơ đồ phản ứng sau:
a) Axit sunfuric + ... → Kẽm sunfat + Nước
b) Natri hiđroxit + ... → Natri sunfat + Nước
c) Nước + ... → Axit sunfurơ
d) Nước + ... → Canxi hiđroxit
e) Canxi oxit + ... → Canxi cacbonat
Dùng các công thức hóa học để viết tất cả những phương trình hóa học của các sơ đồ phản ứng trên.
Phương pháp giải
Ghi nhớ tên gọi của các nguyên tố và công thức hóa học tương ứng của chúng.Lời giải
a) H2SO4 + ZnO → ZnSO4 + H2O
b) 2NaOH + SO3 → Na2SO4 + H2O
c) H2O + SO2 → H2SO3
d) H2O + CaO → Ca(OH)2
e) CaO + CO2 → CaCO3
Bài 4 trang 6 SGK Hóa học 9: Cho những oxit sau:CO2, SO2, Na2O, CaO, CuO. Hãy chọn những chất đã cho tác dụng được với
a) Nước, tạo thành dung dịch axit
b) Nước, tạo thành dung dịch bazơ
c) Dung dịch axit, tạo thành muối và nước.
d) Dung dịch bazơ, tạo thành muối và nước.
Viết các phương trình hóa học.
Phương pháp giải
a) Oxit + Nước tạo dung dịch axit: Oxit axit
b) Oxit + Nước tạo dung dịch bazo: Oxit bazo
c) Oxit + dung dịch axit tạo muối và nước: Oxit bazo
d) Oxit + dung dịch bazo tạo muối và nước: Oxit axit
Lời giải
a) Những chất tác dụng với nước tạo thành dung dịch axit là CO2 và SO2:
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
b) Những chất tác dụng với nước tạo thành dung dịch bazơ là Na2O và CaO:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
c) Những chất tác dụng với dung dịch axit tạo thành muối và nước là: Na2O, CaO, CuO:
Na2O + 2HCl → 2NaCl + H2O
CaO + 2HNO3 → Ca(NO3)2 + H2O
CuO + H2SO4 → CuSO4 + H2O
d) Những chất tác dụng với dung dịch bazơ tạo thành muối và nước là CO2 và SO2:
CO2 + Ca(OH)2 → H2O + CaCO3
SO2 + Ca(OH)2 → H2O + CaSO3
Bài 5 trang 6 SGK Hóa học 9: Có hỗn hợp khí CO2 và O2. Làm thế nào có thể thu được khí O2 từ hỗn hợp trên? Trình bày cách làm và viết phương trình hóa học
Phương pháp giải
Dựa vào tính chất hóa học khác nhau của khí CO2 và O2 để loại bỏ CO2
Lời giải
- Dẫn hỗn hợp khí đi qua một dung dịch kiềm (lấy dư) như Ca(OH)2 hoặc NaOH,... khí CO2 bị hấp thụ hết do có phản ứng với kiềm:
CO2 + Ca(OH)2 → H2O + CaCO3
- Khí thoát ra khỏi bình chỉ có O2 => thu được O2
Bài 6 trang 6 SGK Hóa học 9: Cho 1,6 gam đồng (II) oxit tác dụng với 100 gam dung dịch axit sunfuric có nồng độ 20%.
a) Viết phương trình hóa học.
b) Tính nồng độ phần trăm của các chất có dung dịch sau khi phản ứng kết thúc.
Lời giải chi tiết
Khối lượng axit sufuric:
Tính số mol: nCuO = = 0,02 mol ; = ≈ 0,2 mol
a) Phương trình hóa học: CuO + H2SO4 → CuSO4 + H2O
lúc ban đầu: 0,02 0,2 0 0 mol
lúc phản ứng: 0,02 → 0,02 0,02
Sau phản ứng: 0 0,18 0,02
b) Dung dịch sau phản ứng có hai chất tan là H2SO4 và CuSO4 còn dư.
Khối lượng dung dịch = m CuO + m dd H2SO4 = 1,6 + 100 = 101,6 g
= 0,02 x 160 = 3,2 g => C%, CuSO4 = . 100% ≈ 3,15%
= 20 - (0,02 x 98) = 18,04 => C%, H2SO4 = . 100% ≈ 17,76%
Lý thuyết Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
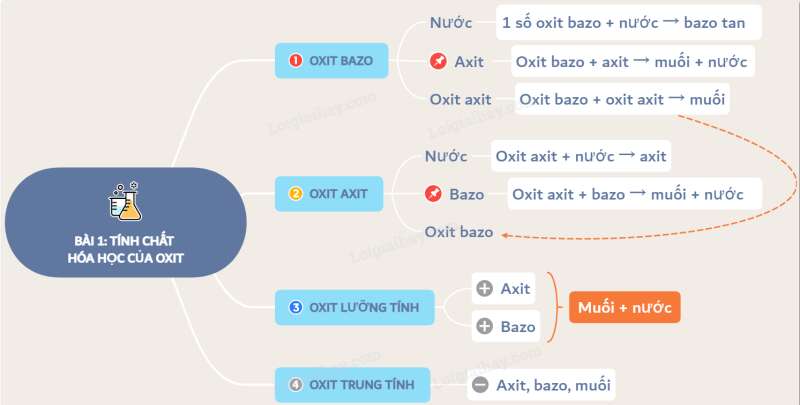
I. Tính chất hóa học của oxit
1. Oxit bazơ: Oxit bazơ có những tính chất hóa học nào ?
a) Tác dụng với nước: Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm).
Thí dụ:
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
Những oxit bazơ tác dụng với nước và do đó cũng tan được trong nước là: Na2O, K2O, CaO, BaO, Li2O, Rb2O, Cs2O, SrO.
b) Tác dụng với axit: Oxit bazơ + axit → muối + nước
Thí dụ:
BaO + 2HCl → BaCl2 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
c) Tác dụng với oxit axit: Một số oxit bazơ, là những oxit bazơ tan trong nước tác dụng với oxit axit tạo thành muối.
Thí dụ:
CaO + CO2 → CaCO3
2. Oxit axit: oxit axit có những tính chất hóa học nào ?
a) Tác dụng với nước: Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
Thí dụ:
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
Những oxit axit tác dụng được với nước và do đó cũng tan trong nước.
b) Tác dụng với dung dịch bazơ: Oxit axit + dd bazơ → muối + nước.
Thí dụ:
CO2 + Ca(OH)2 → H2O + CaCO3
Những oxit khác như SO2, P2O5,…. Cũng có phản ứng tương tự.
c) Tác dụng với oxit bazơ: Oxit axit tác dụng với một số oxit bazơ (tan) tạo thành muối.
Thí dụ:
CO2 + BaO → BaCO3
3. Oxit lưỡng tính: Một số oxit vừa tác dụng dung dịch axit, vừa tác dụng với dung dịch bazơ, gọi là oxit lưỡng tính.
Thí dụ như: Al2O3, ZnO, SnO, Cr2O3,…
Thí dụ:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → H2O + 2NaAlO2 (natri aluminat)
4. Oxit trung tính (hay là oxit không tạo muối): Một số oxit không tác dụng với axit, dung dịch, bazơ, nước, gọi là oxit trung tính như: NO, N2O, CO,…
II. Khái quát về sự phân loại oxit
Căn cứ vào tính chất hóa học của oxit, người ta phân loại oxit thành 4 loại như sau:
Sơ đồ tư duy: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit.
Phương pháp giải một số dạng bài tập về tính chất hóa học của oxit – Khái quát về sự phân loại oxit
Dạng 1
Lý thuyết về tính chất hóa học của oxit – Khái quát về sự phân loại oxit
* Một số lưu ý cần nhớ
Oxit bazơ là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
VD: Na2O, BaO, MgO, ….
Oxit axit là những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
VD: CO2, SO2, SO3, …
Oxit lưỡng tính là những oxit tác dụng với dung dịch axit và tác dụng với dung dịch bazơ tạo thành muối và nước.
VD: Al2O3, ZnO, SnO, PbO
Oxit trung tính hay còn gọi là oxit không tạo muối là những oxit không tác dụng với axit, bazơ, nước
VD: CO, NO, …
* Một số ví dụ điển hình:
Ví dụ 1: Oxit được chia thành mấy loại?
A. 1 loại
B. 2 loại
C. 3 loại
D. 4 loại
Hướng dẫn giải:
Oxit được chia làm 4 loại
+ oxit bazơ
+ oxit axit
+ oxit lưỡng tính
+ oxit trung tính
Đáp án D
Ví dụ 2: Dãy oxit nào sau đây vừa tác dụng với nước, vừa tác dụng với dung dịch bazơ
A. CaO, CuO
B. CO, Na2O.
C. CO2, SO2
D. P2O5, MgO
Hướng dẫn giải:
Chất vừa tác dụng được với nước, vừa tác dụng được với dung dịch bazơ là oxit axit
=> CO2; SO2 thỏa mãn
Đáp án C
Ví dụ 3: Dãy chất sau đây chỉ gồm các oxit:
A. MgO, Ba(OH)2, CaSO4, HCl.
B. MgO, CaO, CuO, FeO.
C. SO2, CO2, NaOH, CaSO4.
D. CaO, Ba(OH)2, MgSO4, BaO.
Hướng dẫn giải:
A. Chỉ có MgO là oxit
B. đúng
C. Chỉ có SO2, CO2 là oxit
D. Chỉ có CaO, BaO là oxit
Đáp án B
Dạng 2
Bài toán về oxit bazo tác dụng với dung dịch axit
* Một số lưu ý cần nhớ:
Oxit bazo + axit => muối + H2O
VD:
CaO + HCl → CaCl2 + H2O
Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
Để làm được dạng bài tập này, các em cần áp dụng theo các bước như sau:
+ Viết phương trình
+ Xác định số mol lượng chất đề bài cho sẵn
+ Từ phương trình hóa học, áp dụng thêm một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của đề bài
* Một số ví dụ điển hình:
Ví dụ 1: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là :
Hướng dẫn giải:
nCaO = 0,1 mol
CaO + 2HCl → CaCl2 + H2O
0,1 mol → 0,2 mol
=> mHCl = 0,2.36,5 = 7,3 gam
=> Khối lượng dd HCl đã dùng là:
Ví dụ 2: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là
Hướng dẫn giải:
nMgO = 0,25 mol
MgO + 2HCl → MgCl2 + H2O
0,25 → 0,5 mol
=> Nồng độ của dung dịch HCl là
Ví dụ 3: Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
Hướng dẫn giải chi tiết:
PTPƯ: FeO + 2HCl → FeCl2 + H2O
0,2 → 0,4 (mol)
VHCl = nHCl : CM = 0,4 : 2 = 0,2 (lít) = 200 (ml)
Dạng 3
Bài toán oxit axit tác dụng với dung dịch kiềm
* Một số lưu ý cần nhớ:
Oxit axit + dung dịch kiềm => muối + H2O
Dung dịch kiềm là dung dịch bazo tan gồm có: NaOH, KOH, Ba(OH)2, Ca(OH)2,
Ví dụ :
CO2 + Ca(OH)2 → H2O + CaCO3
* Một số ví dụ điển hình:
Ví dụ 1: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là
Hướng dẫn giải:
nCO2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
CO2 + 2KOH → K2CO3 + H2O
0,075 mol → 0,075 mol
Vì thể tích dung dịch trước và sau không thay đổi => Vdd = 250 ml = 0,25 lít
Ví dụ 2: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
Hướng dẫn giải:
nBa(OH)2 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3 + H2O
Tỉ lệ 1 1
Phản ứng ?mol 0,04 mol
Từ phương trình => nSO2= n Ba(OH)2 = 0,04 mol
=> VSO2 = nCO2 . 22,4 = 0,04 . 22,4 = 0,896 lít
Dạng 4
Bài tập phản ứng giữa các oxit, nước
* Một số lưu ý cần nhớ:
Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
VD: SO3 + H2O → H2SO4
Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm).
VD: Na2O + H2O → 2NaOH
Oxit axit tác dụng với một số oxit bazơ (tan) tạo thành muối.
VD: CO2 + BaO → BaCO3
* Một số ví dụ điển hình:
Ví dụ 1: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là
Hướng dẫn giải:
SO3 + H2O → H2SO4
0,1 → 0,1 mol
=>
Ví dụ 2: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là:
Hướng dẫn giải:
PTPƯ: Na2O + SO2 → Na2SO3
nNa2O = nSO2=3,36:22,4=0,15(mol)
% mNa2O=
(Lưu ý CuO không phản ứng được với SO2 )
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.