Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Ôn tập chương 1 Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Ôn tập chương 1 Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
Hoàn thành sơ đồ hệ thống hóa kiến thức sau:
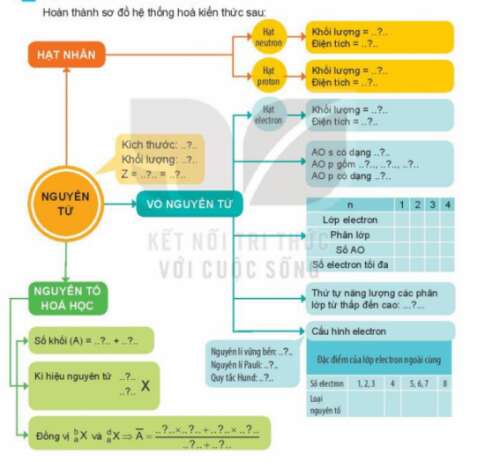

| 1 | 2 | 3 | 4 | |
| Lớp electron | K | L | M | N |
| Phân lớp | 1s | 2s, 2p | 3s, 3p, 3d | 4s, 4p, 4d, 4f |
| Số AO | 1 | 4 | 9 | 17 |
| Số electron tối đa | 2 | 8 | 18 | 34 |
Thứ tự năng lượn các phân lớp từ thấp đến cao: s, p, d, f.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao.
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân tối đa và các electron này có chiều tự quay giống nhau.
Đặc điểm của lớp electron ngoài cùng
| Số electron | 1,2,3 | 4 | 5,6,7 | 8 |
| Loại nguyên tố | Kim loại | Kim loạihoặc phi kim | Phi kim | Khí hiếm(trừ He) |
Nguyên tố hóa học: Số khối (A) = Z + số neutron

Bài tập
Câu 1. Nguyên tử X có 19 proton trong hạt nhân.
Cho các phát biểu sau về X:
1) X có 19 electron ở lớp vỏ nguyên tử.
2) X có 19 neutron trong hạt nhân.
3) X có điện tích hạt nhân là +19.
4) X có số đơn vị điện tích hạt nhân là 19.
Số phát biểu đúng là?
A. 1;
B. 2;
C. 3;
D. 4.
Đáp án: C
Phát biểu 1, 3, 4 đúng.
Phát biểu 2 sai. Chưa thể khẳng định được X có 19 neutron trong hạt nhân.
Câu 2. Số khối của nguyên tử X là 56, trong đó số neutron là 30. Số electron của nguyên tử X là?
A. 26;
B. 21;
C. 22;
D. 23.
Đáp án: A
Số khối A = Z + N
⇒ Số proton của nguyên tử X là: Z = A – N = 56 - 30 = 26.
Số electron = số proton = 26.
Câu 3. Phát biểu nào sau đây không đúng?
A. Proton mang điện tích dương;
B. Hạt nhân nguyên tử được tạo bởi proton và electron;
C. Số proton trong hạt nhân bằng số electron của lớp vỏ nguyên tử;
D. Các electron chuyển động rất nhanh xung quanh hạt nhân.
Đáp án: B
Hạt nhân nguyên tử được tạo bởi các proton mang điện tích dương và các neutron không mang điện.
Câu 4. Hạt nhân nguyên tử X có chứa 11 proton và 12 neutron. Số khối của hạt nhân nguyên tử X là?
A. 23;
B. 24;
C. 27;
D. 25.
Đáp án: A
Số khối của hạt nhân nguyên tử X là: A = Z + N = 11 + 12 = 23.
Câu 5. Một nguyên tử X có 26 proton trong hạt nhân. Khối lượng của proton trong hạt nhân nguyên tử X là?
A. 43,472.10-24 g
B. 43,472.10-26 kg
C. 43,472.10-27 g
D. 43,472.10-24 kg
Đáp án: A
Khối lượng của 1 proton là 1,673.10-27 kg mà X có 26 proton trong hạt nhân.
⇒ Khối lượng của proton trong hạt nhân nguyên tử X là:
26.1,673.10-27 = 4,3498.10-26 kg = 4,3498.10-23 g
Câu 6. Nguyên tử X có chứa 15 proton và 16 neutron. Kí hiệu của nguyên tử X là?
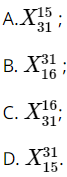
Đáp án: D
Nguyên tử X có 15 proton và 16 neutron nên số khối của nguyên tử X là:
A = Z + N = 15 + 16 = 31 nên kí hiệu của nguyên tử X là ![]() .
.
Câu 7. Phát biểu nào sau đây không đúng về ![]() ?
?
A. Số khối là 63;
B. Số proton là 29;
C. Số neutron là 29;
D. Số đơn vị điện tích hạt nhân là 29.
Đáp án: C
Số neutron là: Z = A – Z = 63 - 29 = 34.
Câu 8. Nguyên tử iron có 4 đồng vị là F54e(chiếm 5,78%), F56e (chiếm 91,72%), F57e (chiếm 2,22%) và F58e (chiếm 0,28%). Nguyên tử khối trung bình của iron (Fe) là?
A. 56;
B. 56,11;
C. 55,91;
D. 59,56.
Đáp án: C
Nguyên tử khối trung bình của iron (Fe) là:
![]() = 55,9122
= 55,9122
Câu 9. Trong tự nhiên, chlorine có 2 đồng vị bền là ![]() và
và ![]() . Nguyên tử khối trung bình của chlorine là 35,485. Thành phần phần trăm của đồng vị
. Nguyên tử khối trung bình của chlorine là 35,485. Thành phần phần trăm của đồng vị ![]() là?
là?
A. 98,85%;
B. 75,75%;
C. 24,25%;
D. 10,15%.
Đáp án: B
Gọi thành phần phần trăm của 2 đồng vị ![]() và
và ![]() lần lượt là x và 100 - x (%)
lần lượt là x và 100 - x (%)
Nguyên tử khối trung bình của chlorine là 35,48.
![]() = 35,485
= 35,485
x = 75,75 (%)
Câu 10. Boron trong tự nhiên gồm có 2 đồng vị là B10 (chiếm 19%) và BX. Biết nguyên tử khối trung bình của boron là 10,81. Giá trị của X là?
A. 10;
B. 11;
C. 12;
D. 13.
Đáp án: B
Thành phần phần trăm của đồng vị BXr là: 100% − 19% = 81%
Nguyên tử khối trung bình của boron là 10,81.
![]() = 10,81
= 10,81
X = 11.
Câu 11. Kí hiệu phân lớp nào sau đây là sai?
A. 2s;
B. 3f;
C. 3d;
D. 4f.
Đáp án: B
Lớp thứ hai có 2 phân lớp là 2s và 2p.
Lớp thứ ba có 3 phân lớp là 3s, 3p và 3d không có phân lớp 3f
Lớp thứ tư có 4 phân lớp là 4s, 4p, 4d và 4f.
Câu 12. Tổng số electron tối đa trong lớp N là?
A. 8;
B. 10;
C. 18;
D. 32.
Đáp án: D
Lớp N có 4 phân lớp là 4s, 4p, 4d và 4f, trong đó phân lớp s chứa tối đa 2e, phân lớp p chứa tối đa 6e, phân lớp d chứa tối đa 10e, phân lớp f chứa tối đa 14e
Tổng số electron tối đa trong lớp N là: 2 + 6 + 10 +14 = 32.
Hoặc có thể giải thích:
Lớp N (n = 4); số electron tối đa là 2.n2 = 2.42 = 32.
Câu 13. Tổng số orbital trong lớp M là?
A. 16;
B. 9;
C. 36;
D. 25.
Đáp án: B
Trong lớp M (n = 3), tổng số orbital là: 32 = 9 AO.
Câu 14. Số electron tối đa trong phân lớp f là?
A. 2;
B. 6;
C. 8;
D. 14.
Đáp án: D
Phân lớp s chứa tối đa 2e
Phân lớp p chứa tối đa 6e
Phân lớp d chứa tối đa 10e
Phân lớp f chứa tối đa 14e
Câu 15. Cho cấu hình electron của các nguyên tử sau đây:
M: 1s22s22p1
N: 1s22s22p5
P: 1s22s22p63s2
Q: 1s22s22p6
Có bao nhiêu nguyên tử là phi kim?
A. 1;
B. 2;
C. 3;
D. 4.
Đáp án: B
Ta có:
N là phi kim vì N có 7 electron ở lớp ngoài cùng.
M có 3 electron ở lớp ngoài cùng, nhưng M là nguyên tử Bo, nên là phi kim (trường hợp đặc biệt);
Loại P do là kim loại; Loại Q do là khí hiếm.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kỳ
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.