Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Định luật tuần hoàn
Nội dung của định luật tuần hoàn: “Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử”.
II. Ý nghĩa của bảng tuần hoàn
Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron nguyên tử, từ đó dự đoán được tính chất hóa học của các nguyên tố.
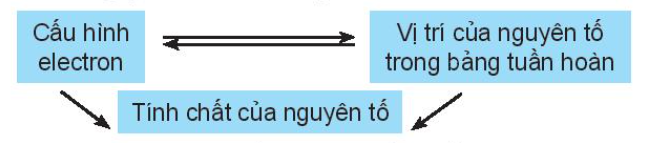
Chú ý: Từ vị trí của nguyên tố trong bảng tuần hoàn, có thể:
- Viết được cấu hình electron của nguyên tử và ngược lại.
- Dự đoán được tính chất (tính kim loại, tính phi kim) của nguyên tố đó.
- Viết được công thức oxide, hydroxide và nêu tính acid, base tương ứng.
Ví dụ 1: Nguyên tố chlorine (Cl) ở ô số 17, nhóm VIIA, chu kì 3.
- Nguyên tử Cl có:
+ 17 proton, 17 electron (do số proton = số electron = Z).
+ 3 lớp electron (do số lớp electron = số thứ tự chu kì).
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng = số thứ tự nhóm A).
Cấu hình electron của Cl: 1s22s22p63s23p5. Cl là nguyên tố phi kim. Oxide cao nhất (Cl2O7) là acidic oxide và acid tương ứng HClO4 là acid mạnh.
Ví dụ 2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
- Nguyên tử P có Z = 15 (do số proton = số electron = Z).
- Nguyên tố P ở chu kì 3, nhóm VA (do có 3 lớp electron và có 5 electron ở lớp ngoài cùng).
- P là nguyên tố phi kim. Oxide cao nhất (P2O5) là acidic oxide và acid tương ứng là (HPO3 hay H3PO4) là acid trung bình.
Ví dụ 3: So sánh tính phi kim của P (Z = 15), O (Z = 8) và S (Z = 16).
P (Z = 15): 1s22s22p63s23p3 → Nguyên tố P thuộc chu kì 3, nhóm VA.
O (Z = 8): 1s22s22p4 → Nguyên tố O thuộc chu kì 2, nhóm VIA.
S (Z = 16): 1s22s22p63s23p4 → Nguyên tố S thuộc chu kì 3, nhóm VIA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần → Tính phi kim: P < S.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần → Tính phi kim: S < O.
Vậy tính phi kim: P < S < O.
Bài tập
Câu 1. Phát biểu đúng về định luật tuần hoàn là
A. Tính chất của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
B. Tính chất của các nguyên tố và đơn chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
C. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của số lớp electron.
D. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Đáp án: D
Giải thích:
Phát biểu đúng về định luật tuần hoàn là:
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Câu 2. Nguyên tử nguyên tố G có cấu hình electron là [Ne] 3s2 3p3. Vị trí của G trong BTH là:
A. ô thứ 15, chu kì 3, nhóm VA;
B. ô thứ 25, chu kì 3, nhóm VB;
C. ô thứ 15, chu kì 2, nhóm IIIA;
D. ô thứ 25, chu kì 3, nhóm IIIA.
Đáp án: A
Giải thích:
G có cấu hình electron: [Ne] 3s2 3p3 ⇒ Z = 15
G có Z = 15 ⇒ G ở ô thứ 15;
G có 3 lớp electron ⇒ G ở chu kì 3;
G là nguyên tố p, có 5 electron lớp ngoài cùng ⇒ G ở nhóm VA
Câu 3. Nguyên tử nguyên tố X có cấu hình e là [Ar] 3d8 4s2. Vị trí của X trong bảng tuần hoàn là:
A. Chu kỳ 3, nhóm VIIIA
B. Chu kỳ 4, nhóm IIB
C. Chu kỳ 4, nhóm IIA
D. Chu kỳ 4, nhóm VIIIB
Đáp án: C
Giải thích:
X có cấu hình electron: [Ar] 3d8 4s2 ⇒ Z = 28
X có Z = 18 ⇒ X ở ô thứ 18;
X có 4 lớp electron ⇒ X ở chu kì 4;
X là nguyên tố s, có 2 electron lớp ngoài cùng ⇒ X ở nhóm IIA
Câu 4. Nguyên tố Y ở chu kì 3, nhóm IA trong bảng tuần hoàn. Tính chất hóa học cơ bản của Y là:
A. kim loại
B. khí hiếm
C. phi kim
D. bazơ
Đáp án: A
Giải thích: Y ở chu kì 3, nhóm IA trong bảng tuần hoàn ⇒ Y là kim loại điển hình.
Câu 5. Cho nguyên tố X có cấu hình electron nguyên tử lớp ngoài cùng và lớp sát ngoài cùng là 4s24p65s2. Vị trí của X trong bảng tuần hoàn là
A. ô thứ 10, chu kì 5, nhóm IIA
B. ô thứ 38, chu kì 5, nhóm IIA
C. ô thứ 28, chu kì 2, nhóm VA
D. ô thứ 28, chu kì 5, nhóm IIA
Đáp án: B
Giải thích:
X có cấu hình electron nguyên tử lớp ngoài cùng và lớp sát ngoài cùng là 4s24p65s2
⇒ cấu hình electron đầy đủ là: 1s22s22p63s23p63d10 là 4s24p65s2 ⇒ Z = 38
Z = 38 ⇒ X ở ô thứ 38
Có 5 lớp electron ⇒ X ở chu kì 5
X là nguyên tố s, có 2 electron lớp ngoài cùng ⇒ X thuộc nhóm IIA.
Câu 6. Y thuộc chu kì 5, nhóm IIA. Công thức oxide và hydroxide cao nhất của Y lần lượt là
A. YO, YOH
B. Y2O, YOH
C. Y2O5, Y(OH)2
D. YO, Y(OH)2
Đáp án: D
Giải thích:
Hóa trị cao nhất của các nguyên tố thuộc nhóm IA đến VIIA (trừ F) = số thứ tự của nhóm.
Y thuộc chu kì 5, nhóm IIA ⇒ Y là kim loại và hóa trị cao nhất của Y là II
Công thức oxide cao nhất là: YO
Công thức hydroxide cao nhất là Y(OH)2
Câu 7. X thuộc chu kì 3, nhóm VIA. Công thức oxide cao nhất của X là
A. X2O3
B. XO2
C. XO3
D. XO6
Đáp án: C
Giải thích:
Hóa trị cao nhất của các nguyên tố thuộc nhóm IA đến VIIA (trừ F) = số thứ tự của nhóm.
X thuộc nhóm VIA ⇒ Hóa trị cao nhất của X là VI
Công thức oxide cao nhất là: XO3
Câu 8. Y là nguyên tố nhóm A có công thức oxide cao nhất là Y2O5. Số thứ tự nhóm của Y là
A. II
B. V
C. IV
D. VI
Đáp án: B
Giải thích:
Công thức oxide cao nhất của Y là Y2O5 ⇒ Hóa trị cao nhất của Y là V
Y là nguyên tố nhóm A nên số thứ tự nhóm = hóa trị cao nhất.
Vậy số thứ tự nhóm của Y là V.
Câu 9. Hydroxide của nguyên tố T có tính base mạnh và tác dụng được với dung dịch HCl theo tỉ lệ mol giữa hydroxide của T và HCl là 1 : 2. Nhóm của T trong bảng tuần hoàn là
A. IA
B. IIA
C. IIIA
D. IVA
Đáp án: B
Giải thích:
Hydroxide của nguyên tố T có tính base mạnh ⇒ công thức có dạng: T(OH)x
T(OH)x + xHCl ⟶ TClx + xH2O
Mà tỉ lệ mol giữa hydroxide của T và HCl là 1 : 2 ⇒ x = 2
⇒ T có hóa trị II mà hydroxide của T có tính base mạnh ⇒ T thuộc nhóm IIA
Câu 10. Oxide cao nhất của X khi tan trong nước tạo thành dung dịch làm quỳ tím chuyển màu xanh. Tỉ lệ nguyên tử X với oxygen trong oxide cao nhất của X là 1 : 1. X thuộc nhóm
A. IIA
B. IIIA
C. VA
D. VIIA
Đáp án: A
Giải thích:
Oxide cao nhất của X khi tan trong nước tạo thành dung dịch làm quỳ tím chuyển màu xanh. ⇒ Oxide cao nhất của X khi tan trong nước tạo thành hydroxide có tính base mạnh. ⇒ X có thể thuộc nhóm IA hoặc IIA.
Tỉ lệ nguyên tử X với oxygen trong oxide cao nhất của X là 1 : 1 ⇒ Oxide cao nhất của X là XO ⇒ Hóa trị cao nhất của X là II.
Vậy X thuộc nhóm IIA.
Câu 11. Cho 5,6 gam oxide của kim loại X (thuộc nhóm IIA) tác dụng vừa đủ với 200 ml dung dịch HCl 1M. Kim loại X là
A. Mg
B. Ca
C. Ba
D. Sr
Đáp án: B
Giải thích:
X thuộc nhóm IIA ⇒ hóa trị II ⇒ Công thức oxide có dạng: XO
nHCl = 0,2.1 = 0,2 (mol)
XO + 2HCl ⟶ XCl2 + H2O
0,1 ← 0,2 (mol)
MXO = 5,60,15,60,1 = 56 (g/mol)
Mà MXO = MX + 16 ⇒ MX + 16 = 56 ⇒ MX = 40 (g/mol)
Vậy X là Ca
Câu 12. Cho X (Z = 8), Y (Z = 16) và T (Z = 15). Sắp xếp các nguyên tố theo thứ tự bán kính nguyên tử tăng dần.
A. X, Y, T
B. T, Y, X
C. X, T, Y
D. Y, T, X
Đáp án: A
Giải thích:
Cấu hình electron của X (Z = 8): 1s22s22p4 ⇒ chu kì 2, nhóm VIA
Cấu hình electron của Y (Z = 16): [Ne]3s23p4 ⇒ chu kì 3, nhóm VIA
Cấu hình electron của T (Z = 15): [Ne]3s23p3 ⇒ chu kì 3, nhóm VA
Y và T cùng thuộc chu kì 3 mà điện tích hạt nhân của T < Y.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân bán kính nguyên tử có xu hướng giảm.
Do đó, bán kính nguyên tử của T > Y
X và Y cùng thuộc nhóm VIA mà điện tích hạt nhân của X < Y.
Trong cùng một nhóm, theo chiều tăng dần của điện tích hạt nhân bán kính nguyên tử có xu hướng tăng.
Do đó, bán kính nguyên tử của X < Y
Vậy bán kính nguyên tử của X < Y < T.
Câu 13. Sắp xếp các nguyên tố C, O, Si theo chiều tính phi kim tăng dần.
A. C, O, Si
B. Si, C, O
C. Si, O, C
D. C, Si, O
Đáp án: B
Giải thích:
Theo chiều tăng dần của điện tích hạt nhân, tính phi kim của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
C (Z = 6): chu kì 2, nhóm IVA
O (Z = 8): chu kì 2, nhóm VIA
Si (Z = 14): chu kì 3, nhóm IVA
C và O cùng ở chu kì 2, theo chiều tăng dần của điện tích hạt nhân, tính phi kim của C < O.
C và Si cùng ở nhóm IVA, theo chiều tăng dần của điện tích hạt nhân, tính phi kim của C > Si.
Vậy tính phi kim của Si < C < O.
Câu 14. Sắp xếp các hydroxide H2SiO3, H3PO4, HClO4 theo chiều tính acid giảm dần là
A. H2SiO3, H3PO4, HClO4
B. H3PO4, HClO4, H2SiO3
C. HClO4, H2SiO3, H3PO4
D. HClO4, H3PO4, H2SiO3
Đáp án: D
Giải thích:
Theo chiều tăng dần của điện tích hạt nhân, tính acid của hydroxide tăng trong cùng một chu kì.
Si (Z = 14): chu kì 3, nhóm IVA
P (Z = 15): chu kì 3, nhóm VA
Cl (Z = 17): chu kì 3, nhóm VIIA
Si, P, Cl cùng thuộc chu kì 3 theo chiều tăng dần của điện tích hạt nhân, tính acid của H2SiO3 < H3PO4 < HClO4.
Sắp xếp theo chiều giảm dần là: HClO4, H3PO4, H2SiO3
Câu 15. Sắp xếp các oxide MgO, Al2O3, Na2O theo chiều tính base tăng dần là
A. MgO, Al2O3, Na2O
B. Al2O3, MgO, Na2O
C. Na2O, Al2O3, MgO
D. Na2O, MgO, Al2O3
Đáp án: B
Giải thích:
Theo chiều tăng dần của điện tích hạt nhân, tính base của oxide giảm trong cùng một chu kì.
Mg (Z = 12): chu kì 3, nhóm IIA
Al (Z = 13): chu kì 3, nhóm IIIA
Na (Z = 11): chu kì 3, nhóm IA
Na, Mg, Al cùng thuộc chu kì 3 theo chiều tăng dần của điện tích hạt nhân, tính base của Na2O > MgO > Al2O3
Thứ tự tính base tăng là Al2O3, MgO, Na2O
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kỳ
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.