Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Ôn tập chương 2 Kết nối tri thức (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Ôn tập chương 2 Kết nối tri thức (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Hệ thống hóa kiến thức
1. Cấu tạo bảng tuần hoàn
a) Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron → cùng chu kì (hàng).
- Cùng số electron hóa trị → cùng nhóm (cột).
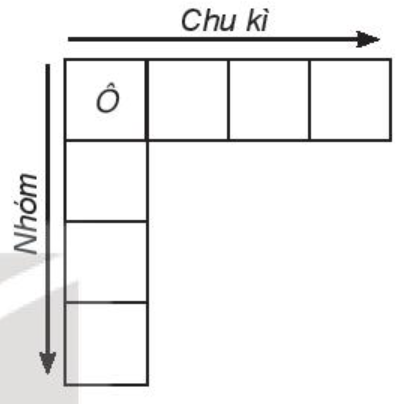
b) Trong bảng tuần hoàn (đến năm 2016) có 118 nguyên tố, 7 chu kì và 18 nhóm.
2. Xu hướng biến đổi trong bảng tuần hoàn
a) Bán kính nguyên tử
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
b) Giá trị độ âm điện
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
c) Tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
d) Tính acid – base của các oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
3. Bảng tuần hoàn và cấu tạo nguyên tử
Nhận xét:
Số proton = số electron = số hiệu nguyên tử = số Z
Số thứ tự chu kì = số lớp electron
Số thứ tự nhóm A = số electron lớp ngoài cùng
4. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
5. Ví dụ luyện tập
Ví dụ 1. Cho các nguyên tố X (Z = 11), Y (Z = 13), T (Z = 14), Q (Z = 19).
a) So sánh tính kim loại
b) So sánh bán kính nguyên tử
Hướng dẫn giải:
X (Z = 11): 1s22s22p63s1 → X thuộc chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 → Y thuộc chu kì 3, nhóm IIIA.
T (Z = 14): 1s22s22p63s23p2 → T thuộc chu kì 3, nhóm IVA.
Q (Z = 19): 1s22s22p63s23p64s1 → Q thuộc chu kì 4, nhóm IA.
a) So sánh tính kim loại.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
→ Tính kim loại: X > Y > T.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
→ Tính kim loại: X < Q.
Vậy, tính kim loại: Q > X > Y > T.
b) So sánh bán kính nguyên tử
Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
→ Bán kính nguyên tử: X > Y > T.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
→ Bán kính nguyên tử: X < Q.
Vậy, bán kính nguyên tử: Q > X > Y > T.
Ví dụ 2. Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn.
a) Viết cấu hình electron của nguyên tử S.
b) Xác định số proton, electron của nguyên tử S.
c) Viết công thức oxide cao nhất và hydroxide cao nhất của S.
Hướng dẫn giải:
a)
Số thứ tự chu kì = số lớp electron = 3.
Số thứ tự nhóm A = số electron lớp ngoài cùng = 6.
→ Cấu hình electron của nguyên tử S: 1s22s22p63s23p4.
b) Số proton = số electron = Z = 16.
c) S thuộc nhóm VIA → Hóa trị cao nhất của S là VI.
Công thức oxide cao nhất của S là SO3 (acidic oxide).
Công thức hydroxide cao nhất là H2SO4 (có tính acid).
Bài tập
Câu 1. Chu kì là gì?
A. Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần;
B. Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số khối tăng dần;
C. Gồm các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột;
D. Gồm các nguyên tố mà nguyên tử của chúng có số neutron giống nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
Đáp án: A
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Câu 2. Nhóm là gì?
A. Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần;
B. Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số khối tăng dần;
C. Gồm các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột;
D. Gồm các nguyên tố mà nguyên tử của chúng có số neutron giống nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
Đáp án: C
Nhóm gồm các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
Câu 3. Chu kì 6 trong bảng tuần hoàn gồm có bao nhiêu nguyên tố?
A. 2;
B. 8;
C. 18;
D. 32.
Đáp án: D
Chu kì 1 gồm 2 nguyên tố, chu kì 2 và 3 gồm 8 nguyên tố, chu kì 4 và 5 gồm 18 nguyên tố, chu kì 6 và 7 gồm 32 nguyên tố.
Câu 4. Các nguyên tố thuộc nhóm VIIA được gọi là gì?
A. Nhóm kim loại kiềm;
B. Nhóm kim loại kiềm thổ;
C. Nhóm halogen;
D. Nhóm nguyên tố khí hiếm.
Đáp án: C
Nhóm kim loại kiềm (nhóm IA)
Nhóm kim loại kiềm thổ (nhóm IIA)
Nhóm halogen (nhóm VIIA)
Nhóm nguyên tố khí hiếm (nhóm VIIIA).
Câu 5. Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(1) Các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
(2) Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
(3) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
(4) Các nguyên tố được sắp xếp theo chiều tăng dần của nguyên tử khối.
Số nguyên tắc đúng là:
A. 2;
B. 3;
C. 4;
D. 1.
Đáp án: B
Những nguyên tắc đúng: (1), (2), (3).
Câu 6. Trong một chu kì của bảng tuần hoàn theo chiều tăng dần điện tích hạt nhân nguyên tử thì
A. Tính phi kim giảm dần;
B. Bán kính nguyên tử giảm dần;
C. Độ âm điện giảm dần;
D. Tính kim loại tăng dần.
Đáp án: B
Trong một chu kì của bảng tuần hoàn theo chiều tăng dần điện tích hạt nhân nguyên tử thì bán kính nguyên tử giảm dần, độ âm điện tăng dần và tính kim loại giảm dần đồng thời tính phi kim tăng dần.
Câu 7. Dãy nào dưới đây đều là các nguyên tố khí hiếm?
A. Chlorine (Cl), hydrogen (H), oxygen (O).
B. Helium (He), neon (Ne), argon (Ar).
C. Carbon (C), helium (He), sodium (Na).
D. Aluminium (Al), iron (Fe), potassium (K)
Đáp án: B
Các nguyên tố khí hiếm là: helium (He), neon (Ne), argon (Ar).
Chlorine (Cl), hydrogen (H), oxygen (O), carbon (C) là các nguyên tố phi kim.
Sodium (Na), aluminium (Al), iron (Fe), potassium (K) là các nguyên tố kim loại.
Câu 8. Dãy nguyên tố nào sau đây sắp xếp theo chiều giảm dần tính kim loại?
A. Mg, Al, Cl, Ba;
B. Cl, Al, Mg, Al;
C. Ba, Cl, Mg, Al;
D. Ba, Mg, Al, Cl.
Đáp án: D
Ba, Mg đều thuộc nhóm IIA nên tính kim loại của Ba > Mg;
Mg, Al và Cl đều thuộc chu kì 3 nên tính kim loại Mg > Al > Cl.
Vậy tính kim loại: Ba > Mg > Al > Cl.
Câu 9. Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 11, 12, 16. Phát biểu nào sau đây là sai?
A. Các nguyên tố này đều là phi kim;
B. Các nguyên tố này đều thuộc cùng một chu kì;
C. Thứ tự giảm dần tính kim loại: X > Y > Z;
D. Thứ tự độ âm điện: X < Y < Z.
Đáp án: A
X, Y Z lần lượt là các nguyên tố Na, Mg, S đều thuộc chu kì 3 có Na và Mg là kim loại, S là phi kim.
Câu 10. Nguyên tố nào có công thức oxide (với hóa trị cao nhất) là R2O3?
A. Carbon (C);
B. Sodium (Na);
C. Aluminium (Al);
D. Nitrogen (N).
Đáp án: C
Công thức oxide (với hóa trị cao nhất) là R2O3
R thuộc nhóm IIIA
Nguyên tố cần tìm là aluminium (Al).
Câu 11. Nguyên tố X thuộc nhóm A của bảng tuần hoàn. Oxide ứng với hóa trị cao nhất của X là X2O7. Số electron hóa trị của X là?
A. 4;
B. 5;
C. 6;
D. 7.
Đáp án: D
Oxide ứng với hóa trị cao nhất của X là X2O7
X có hóa trị cao nhất trong hợp chất với oxygen là VII.
X có 7 electron hóa trị.
Câu 12. Cho X và Y là hai nguyên tố thuộc cùng nhóm và ở hai chu kì liên tiếp. Tổng số proton của X và Y là 32. X và Y là?
A. Ca và Mg;
B. Si và S;
C. P và Cl;
D. K và Al.
Đáp án: A
X và Y là hai nguyên tố thuộc cùng nhóm và ở hai chu kì liên tiếp
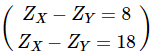
Tổng số proton của X và Y là 32 ⇒ ZX + ZY = 32
TH1: 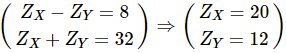
Zx = 20 X là Ca
Zy = 12 Y là Mg
TH2: 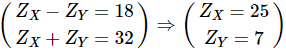 (loại)
(loại)
Vậy X và Y là Ca và Mg.
Câu 13. Cho công thức hydroxide ứng với hóa trị cao nhất của X là H2XO4, trong đó X chiếm 32,65% về khối lượng. Xác định nguyên tố X.
A. Sulfur (S);
B. Phosphorus (P);
C. Carbon (C);
D. Nitrogen (N).
Đáp án: A
Công thức hydroxide ứng với hóa trị cao nhất của X là H2XO4, trong đó X chiếm 32,65% về khối lượng
![]() × 100% = 32,65%
× 100% = 32,65%
MX = 32
X là sulfur (S).
Câu 14. Cho những đại lượng và tính chất sau:
(1) Khối lượng nguyên tử
(2) Số hiệu nguyên tử
(3) Tính kim loại
(4) Tính acid - base của các hidroxide
(5) Cấu hình electron nguyên tử lớp ngoài cùng
(6) Tính phi kim.
Số những đại lượng và tính chất không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử là?
A. 1;
B. 2;
C. 3;
D. 4.
Đáp án: B
Những đại lượng và tính chất không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử là: 1 và 2.
Câu 15. Đơn chất của các nguyên tố có tính chất hóa học tương tự nhau là?
A. F, Cl, Br, I;
B. O, N, S, P;
C. Ca, Na, Mg, K;
D. Al, Cu, Fe, Ag.
Đáp án: A
F, Cl, Br, I đều thuộc nhóm VIIA nên có tính chất hóa học tương tự nhau.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.