Với Giải SBT Hóa học 10 trang 9 trong Bài 3: Cấu trúc lớp vỏ electron nguyên tử Sách bài tập Hóa học lớp 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 9.
SBT Hóa học 10 trang 9
Bài 3.11 trang 9 sách bài tập Hóa học 10: Phân lớp 3d có số electron tối đa là
A. 6
B. 18
C. 14
D. 10
Lời giải:
Đáp án đúng là: D
Phân lớp d có 5 AO. Mỗi AO chứa tối đa 2 electron
⇒Phân lớp 3d có số electron tối đa là 5.2 = 10 electron.
Bài 3.12 trang 9 sách bài tập Hóa học 10: Lớp L có số phân lớp electron bằng
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: B
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
Phân lớp L (n = 2) có 2 phân lớp là 2s và 2p.
Bài 3.13 trang 9 sách bài tập Hóa học 10: Lớp M có số orbital tối đa bằng
A. 3
B. 4
C. 9
D. 18
Lời giải:
Đáp án đúng là: C
Trong lớp electron thứ n có n2 AO (n ≤ 4)
Lớp M (n = 3) có 32 = 9 AO
Bài 3.14 trang 9 sách bài tập Hóa học 10: Lớp M có số electron tối đa bằng
A. 3
B. 4
C. 9
D. 18
Lời giải:
Đáp án đúng là: D
Trong lớp electron thứ n có n2 AO (n ≤ 4)
Mỗi AO chứa tối đa 2 electron
⇒Lớp M (n = 3) có số electron tối đa bằng 2.32 =18 electron.
Bài 3.15 trang 9 sách bài tập Hóa học 10: Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6
B. 8
C. 14
D. 16
Lời giải:
Đáp án đúng là: D
Theo chiều tăng của mức năng lượng: 1s 2s 2p 3s 3p 4s …
Lớp thứ 3 có 6 electron ⇒ 2 electron được điền vào 3s và 4 electron được điền vào 3p
Cấu hình electron của X là: 1s2 2s2 2p6 3s2 3p4
Bài 3.16 trang 9 sách bài tập Hóa học 10: Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
A. K
B. L
C. M
D. N
Lời giải:
Đáp án đúng là: C
Xcó Z = 17 nên nguyên tử X có 17 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p5.
⇒ Cấu hình electron của nguyên tử X là: 1s22s22p63s23p5.
⇒ Electron lớp ngoài cùng của X thuộc lớp thứ 3 (lớp M)
Bài 3.17 trang 9 sách bài tập Hóa học 10: Cách biểu diễn electron trong AO nào sau đây không tuân theo nguyên lí Pauli?
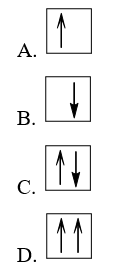
Lời giải:
Đáp án đúng là: B và D
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên, nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
Bài 3.18 trang 9 sách bài tập Hóa học 10: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
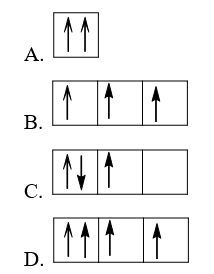
Lời giải:
Đáp án đúng là: B
Sự phân bố electron theo ô orbital trên các lớp và phân lớp cần tuân theo nguyên lí Pauli và quy tắc Hund.
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
⇒ A, D sai.
+ Quy tắc Hund: Trong cùng một lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
⇒ B đúng, C sai (vì số electron độc thân chưa đạt tối đa)
Bài 3.19 trang 9 sách bài tập Hóa học 10: Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s.
Lời giải:
Nếu orbital s chỉ chứa 1 electron:![]()
Nếu orbital s chứa 2 electron:![]()
Chú ý: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí Pauli). Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên (![]() ), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước (
), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước (![]() )
)
Bài 3.20 trang 9 sách bài tập Hóa học 10: rường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund?
Lời giải:
Trường hợp orbital p có chứa 2 electron, có rất nhiều cách để biểu diễn 2 electron trong AOp. Ví dụ một số cách:
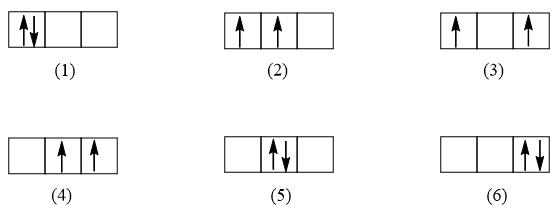
Tuy có nhiều cách biểu diễn nhưng chỉ có trường hợp (2) tuân theo quy tắc Hund (số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau).
Chú ý: Theo nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau. Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên (![]() ), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước (
), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước (![]() )
)
Bài 3.21 trang 9 sách bài tập Hóa học 10: Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron.
Lời giải:
Mối quan hệ về năng lượng:
- Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân. Mức năng lượng tăng dần theo lớp electron: K < L < M < N < O < …
- Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau. Mức năng lượng tăng dần theo AO: s < p < d < f.
- Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Bài 3.22 trang 9 sách bài tập Hóa học 10: Cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p;
b) Phân lớp d;
c) Lớp K;
d) Lớp M.
Lời giải:
Chú ý:
+ Lớp electron thứ n có n2 AO (n ≤ 4)
+ Mỗi AO chứa tối đa 2 electron
a) Phân lớp p có 3 AO px, py, pz
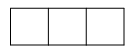
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp p là 2.3 = 6 electron
b) Phân lớp d có 5 AO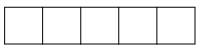
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp d là 2.5 = 10 electron
c) Lớp K (n = 1) có 12 = 1 AO.
⇒ Số electron tối đa trong lớp K là 2.1 = 2 electron.
d) Lớp M (n = 3) có 32 = 9 AO
⇒ Số electron tối đa trong lớp M là 2.9 = 18 electron.
Xem thêm lời giải vở bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.