Với Giải SBT Hóa học 10 trang 10 trong Bài 3: Cấu trúc lớp vỏ electron nguyên tử Sách bài tập Hóa học lớp 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 trang 10.
Nội dung bài viết
SBT Hóa học 10 trang 10
Bài 3.23 trang 10 sách bài tập Hóa học 10: Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17.
Viết cấu hình electron nguyên tử của nguyên tố X và Y. Khi nguyên tử của nguyên tố X nhường đi hai electron và nguyên tử của nguyên tố Y nhận thêm một electron thì lớp electron ngoài cùng của chúng có đặc điểm gì?
Lời giải:
– Nguyên tử X (Z = 12) có cấu hình electron: 1s22s22p63s2
X nhường đi 2 electron: X → X2+ + 2e
Cấu hình electron của ion X2+ là 1s22s22p6
- Nguyên tử Y (Z = 17) có cấu hình electron: 1s22s22p63s23p5
Y nhận thêm 1 electron: Y + e → Y-
Cấu hình electron của Y- là 1s22s22p63s23p6
- Cấu hình electron của ion X2+ giống khí hiếm Ne, có 8 electron lớp ngoài cùng.
- Cấu hình electron của ion Y-giống với cấu hình electron của khí hiếm Ar, có 8 electron lớp ngoài cùng.
Bài 3.24 trang 10 sách bài tập Hóa học 10: Viết cấu hình electron theo ô orbital của nguyên tử các nguyên tố có Z = 9, Z = 14 và Z = 21. Chúng là nguyên tố kim loại, phi kim hay khí hiếm?
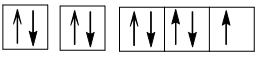
+) Z = 9 (1s22s22p5): nguyên tử có 7 electron hóa trị, dễ thu electron, là phi kim.
Cấu hình electron theo ô orbital:
+) Z = 14 (1s22s22p63s23p2): nguyên tử có 4 electron hóa trị nên có thể thu electron hoặc nhường electron, là phi kim.
Cấu hình electron theo ô orbital:
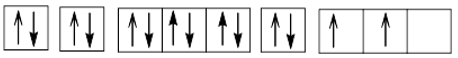
+) Z = 21 (1s22s22p63s23p63d14s2): nguyên tử có 3 electron hóa trị, dễ nhường electron, là kim loại.

Bài 3.25 trang 10 sách bài tập Hóa học 10: Hợp chất A có công thức M4X3. Tổng số hạt proton, electron và neutron trong phân tử A là 214. Tổng số hạt proton, neutron, electron của [M]4 nhiều hơn so với [X]3 trong A là 106.
a) Xác định công thức hóa học của A.
b) Viết cấu hình electron của các nguyên tử tạo nên A.
Lời giải:
Lời giải:
a) Coi tổng số hạt trong [M] là x và [X] là y
Theo bài ra ta có: 4x + 3y = 214 (I)
và 4x – 3y = 106 (II)
Giải hệ (I) và (II), ta được: x = 40 và y = 18.
Số p = số e nên ta có:
2pM + nM = 40 với 1≤nMpM≤1,51≤nMpM≤1,5 và pM < 20
⇒ pM = 13 và nM = 14
⇒ M là 13Al.
2pX + nX = 18 với 1≤nXpX≤1,51≤nXpX≤1,5 và pX < 9
⇒ pX = 6 và nX = 6
⇒ X là 6C.
Công thức hóa học của A là Al4C3.
b) Cấu hình electron: 13Al (1s22s22p63s23p1) và 6C (1s22s22p2)
Xem thêm lời giải vở bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.