Toptailieu.vn biên soạn và giới thiệu các kiến thức trọng tâm về Nhôm (Al) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Nhôm, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Nhôm (Al): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Nhôm là tên một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Al. Nhôm là nguyên tố phổ biến thứ 3, và là kim loại phổ biến nhất trong vỏ Trái Đất.
- Kí hiệu: Al
- Cấu hình electron: 1s22s22p63s23p1 hay [Ne]3s223p1
- Số hiệu nguyên tử: 13
- Khối lượng nguyên tử: 27 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 13
+ Nhóm: IIIA
+ Chu kì: 3
- Đồng vị: Thường chỉ gặp 27Al
- Độ âm điện: 1,61
1. Tính chất vật lí:
- Nhôm là kim loại nhẹ (khối lượng riêng 2,7g/cm3).
- Màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm (660oC).
- Nhôm mềm, dễ kéo sợi và dễ dát mỏng.
- Nhôm dẫn điện và dẫn nhiệt tốt.
2. Nhận biết
Cho Al phản ứng với dung dịch NaOH (hoặc KOH). Hiện tượng quan sát được: Nhôm tan dần, sinh ra khí không màu.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
1. Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
3. Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
4. Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
6. Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
- Trong tự nhiên chỉ tồn tại dưới dạng hợp chất.
- Có trong: Đất sét (Al2O3.2SiO2.2H2O), mica (K2O.Al2O2.6H2O), boxit (Al2O3.2H2O), criolit (3.NaF.AlF3)...
- Nguyên liệu là quặng Boxit (Al2O3.2H2O).
- Điện phân nóng chảy oxit nhôm trong criolit.
- Hợp kim nhôm, nhẹ và bền, được dùng để chế tạo các chi tiết của phương tiện vận tải (ô tô, máy bay, xe tải, toa xe tàu hỏa, tàu biển, v.v.)
- Nhôm và hợp kim của nhôm được dùng trong xây dựng nhà cửa và trang trí nội thất.
- Nhôm được dùng làm dây dẫn điện thay cho đồng.
- Dùng làm dụng cụ nhà bếp.
- Bột nhôm trộn với bột sắt oxit (hỗn hợp tecmit) được dùng để hàn đường ray.
- Phèn chua K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O
VIII. Bài tập liên quan về Nhôm (Al)
Ví dụ 1: Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng kim loại nào sau đây để làm sạch dung dịch muối nhôm?
A. Al.
B. Cu.
C. Fe.
D. Ag.
Lời giải:
Đáp án A
Sử dụng một lượng dư kim loại nhôm.
2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Lọc bỏ kim loại thu được dung dịch muối nhôm tinh khiết.
Ví dụ 2: Viết các phương trình hóa học thực hiện những chuyển đổi hóa học sau:
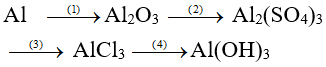
Hướng dẫn giải:
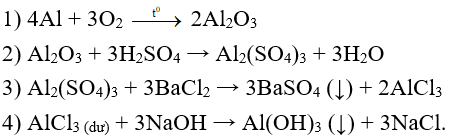
Ví dụ 3: Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là
A. 1,8 gam.
B. 2,7 gam.
C. 4,05 gam.
D. 5,4 gam.
Lời giải:
Đáp án B
Ta có: nkhí = 0,15 mol
2Al + 6HCl → 2AlCl3 + 3H2
0,1………………………0,15 mol
→ mAl = 0,1.27 = 2,7 gam.
Ví dụ 4: Khí Cl2 ẩm có tính tẩy màu là do
A. Cl2 có tính oxi hóa mạnh.
B. Cl2 tác dụng với nước tạo thành HClO có tính tẩy màu.
C. Cl2 tác dụng với nước tạo thành dung dịch axit.
D. Cl2 vừa có tính oxi hóa, vừa có tính khử.
Hướng dẫn giải:
Chọn B
Khi tan trong nước, một phần khí clo tác dụng với nước theo phản ứng thuận nghịch:
Axit hipoclorơ có tính oxi hóa rất mạnh, nó phá hủy các chất màu, vì thế clo ẩm có tác dụng tẩy màu.
Ví dụ 5: Đốt 28 gam bột sắt trong khí clo dư. Khối lượng muối clorua sinh ra là
A. 32,50 gam
B. 24,50 gam
C. 81,25 gam
D. 25,40 gam
Hướng dẫn giải:
Đáp án C
Ta có: nFe = 0,5 mol
Ví dụ 6:Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg
B. Al
C. Fe
D. Zn
Hướng dẫn giải:
Đáp án B
Với n = 3 → M = 27 (Al).
Ví dụ 7: Hiện tượng xảy ra khi cho dây sắt nóng đỏ vào bình đựng khí clo là:
A. Có khói trắng
B. Có khói nâu
C. Có khói đen
D. Có khói tím
Hướng dẫn giải:
Đáp án B
2Fe + 3Cl2 → 2FeCl3 (có màu nâu)
Ví dụ 8: Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình kín chứa khí clo dư, sau phản ứng thì lượng clo trong bình giảm tương ứng 0,4 mol. Khối lượng muối clorua khan thu được là.
A. 65,0 g. B. 38,0 g. C. 50,8 g. D. 42,0 g.
Hướng dẫn giải
Đáp án D
mmuối = mKL
Xem thêm các chất hữu cơ chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.