Toptailieu.vn biên soạn và giới thiệu các kiến thức trọng tâm về Natri (Na) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của natri, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Natri (Na): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
I. Định nghĩa Natri (Na) là gì?
- Natri là nguyên tố phổ biến nhất thứ 6 trong vỏ Trái Đất, và có mặt trong nhiều loại khoáng vật như felspat, sodalit và đá muối.
- Kí hiệu: Na
- Cấu hình electron: 1s22s22p63s1 hay [Ne]3s1
- Số hiệu nguyên tử: 11
- Khối lượng nguyên tử: 23 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: 11
+ Nhóm: IA
+ Chu kì: 3
- Đồng vị: 22Na, 23Na.
- Độ âm điện: 0,93.
II. Tính chất vật lí & nhận biết Natri (Na)
1. Tính chất vật lí:
- Kim loại kiềm màu trắng – bạc, nhẹ, rất mềm, dễ nóng chảy.
- Có khối lượng riêng là 0,968 g/cm3; có nhiệt độ nóng chảy là 97,830C và sôi ở 8860C.
2. Nhận biết
- Đốt cháy các hợp chất của Natri sẽ cho ngọn lửa có màu vàng.
III. Tính chất hóa học của Natri (Na)
- Natri có tính khử rất mạnh: Na → Na+ + 1e
a. Tác dụng với phi kim
4Na + O2 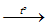
2Na + Cl2 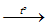
- Khi đốt trong không khí hay trong oxi, Na cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu vàng đặc trưng.
b. Tác dụng với axit
- Natri dễ dàng khử ion H+ trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Na + 2HCl → 2NaCl + H2.
2Na + H2SO4 → Na2SO4 + H2.
c. Tác dụng với nước
- Natri đều tác dụng mãnh liệt với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Na + 2H2O → 2NaOH + H2.
d. Tác dụng với hidro
- Natri tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành natri hidrua.
2Na (lỏng) + H2 (khí) 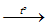
IV. Trạng thái tự nhiên của Natri (Na)
- Trong tự nhiên, Na có 13 đồng vị của natri đã được biết đến. Đồng vị ổn định duy nhất là 23Na.
- Natri chiếm khoảng 2,6% theo khối lượng của vỏ Trái Đất, làm nó trở thành nguyên tố phổ biến thứ tám nói chung và là kim loại kiềm phổ biến nhất.
V. Điều chế
- Điện phân muối halogenua hay hidroxit nóng chảy.
2NaCl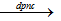
VI. Ứng dụng của Natri (Na)
- Natri là thành phần quan trọng trong sản xuất este và các hợp chất hữu cơ. Kim loại kiềm này là thành phần của clorua natri (NaCl) (muối ăn) là một chất quan trọng cho sự sống.
Các ứng dụng khác:
• Trong một số hợp kim để cải thiện cấu trúc của chúng.
• Trong xà phòng (trong hợp chất với các axít béo).
• Để làm trơn bề mặt kim loại.
• Để làm tinh khiết kim loại nóng chảy.
• Trong các đèn hơi natri, một thiết bị cung cấp ánh sáng từ điện năng có hiệu quả.
• Như là một chất lỏng dẫn nhiệt trong một số loại lò phản ứng nguyên tử.
VII. Các hợp chất quan trọng của Natri:
- Natri hidroxit: NaOH
- Natri hiđrocacbonat: NaHCO3
- Natri cacbonat: Na2CO3
VIII. Bài tập liên quan về Natri (Na)
Ví dụ 1: Cho Na tác dụng với khí clo trong bình nhiệt độ cao. Phản ứng xảy ra với hiệu ứng nhiệt:
A. ΔH = 0 B. ΔH > 0 C. ΔH < 0 D. Không xác định
Hướng dẫn giải:
Đáp án C
Phản ứng đốt cháy Na trong Cl2 tỏa nhiệt mạnh.
Ví dụ 2: Cho 2,3 g Na đun nóng trong khí clo thu được m g muối. Giá trị của m là:
A. 5,85 g B. 2,95 g C. 11,7 g D. 8,775 g
Hướng dẫn giải:
Đáp án A
2Na + Cl2 → 2NaCl
nNaCl = nNa = 0,1 mol ⇒ mNaCl = 0,1.58,5 = 5,85 g
Ví dụ 3: Cho Na tác dụng với Clo nung nóng. Hiện tượng phản ứng xảy ra là:
A. Natri nóng chảy cháy sáng trong khí clo
B. Natri phản ứng dịu nhẹ với khí clo
C. Natri phản ứng tỏa nhiều nhiệt khi tác dụng với khí clo đun nóng
D. Natri tác dụng mãnh liệt với khí clo khi tiếp xúc.
Hướng dẫn giải:
Đáp án A.
Ví dụ 4: Cho Na tác dụng với dung dịch brom dư thu được 1,03 g muối. Khối lương Na tham gia phản ứng là
A. 0,23 g B. 2,3 g C. 4,6 g D. 0,115 g
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng: Na + Br2 → NaBr
nNa = nNaBr = 1,03/103 = 0,01 mol ⇒ mNa = 0,01.23 = 0,23 g
Ví dụ 5: Cách bảo quản Na đúng nhất :
A. Để ngoài không khí B. Ngâm trong rượu
C. Ngâm trong dầu hỏa D. Để trong chai đen, kín
Hướng dẫn giải:
Đáp án C
Ví dụ 6: Trong phòng thí nghiệm để tiêu hủy các mẩu Na dư, trong các cách sau đây cách nào đúng?
A. Cho vào máng nước thải
B. Cho vào dầu hỏa
C. Cho vào cồn=96o
D. Cho vào dung dịch NaOH
Hướng dẫn giải:
Đáp án C
Na phản ứng với cồn thu được muối
Phương trình phản ứng: 2Na + 2C2H5OH → 2C2H5ONa + H2
Xem thêm các chất hữu cơ chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.