Toptailieu.vn biên soạn và giới thiệu lời giải SBT Hóa 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hoá học hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
SBT Hóa 11 (Kết nối tri thức) Bài 1: Khái niệm về cân bằng hoá học
Bài 1.1 trang 5 SBT Hóa 11: Phản ứng nào sau đây là phản ứng thuận nghịch?
A. Mg+2HCl→MgCl2+H2.
B. 2SO2+O2⇌2SO3.
C. C2H5OH+3O2to→2CO2+3H2O.
D. 2KClO3to→2KCl+3O2.
Lời giải:
Đáp án đúng là: B
Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau là chiều thuận và chiều nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều ⇌.
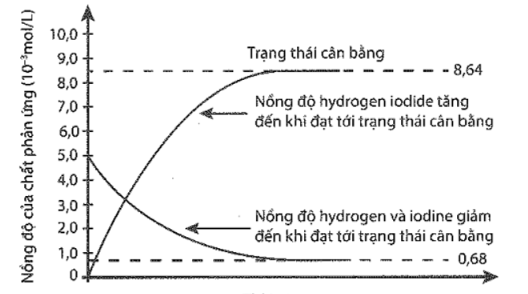
Nồng độ của HI ở trạng thái cân bằng là
A. 0,68 M.
B. 5,00 M.
C. 3,38 M.
D. 8,64 M.
Lời giải:
Đáp án đúng là: D
Phương trình phản ứng H2(g)+I2(g)⇌2HI(g)
Nhìn vào đồ thị ta thấy ở trạng thái cân bằng [H2] = [I2] = 0,68 M ; [HI] = 8,64M.
Bài 1.3 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau: Br2(
Biểu thức hằng số cân bằng (Kc) của phản ứng trên là
A. .
B. .
C. .
D. .
Lời giải:
Đáp án đúng là: B
Biểu thức hằng số cân bằng (Kc) của phản ứng trên là
Bài 1.4 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau:
Ở , nồng độ các chất ở trạng thái cân bằng như sau: .
Hằng số cân bằng Kc của phản ứng tại ToC là
A. 1,68.
B. 48,16.
C. 0,02.
D. 16,95.
Lời giải:
Đáp án đúng là: B
Hằng số cân bằng Kc của phản ứng tại ToC là :
= = 48,16
Bài 1.5 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau:
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Thêm chất xúc tác.
B. Giảm nồng độ N2 hoặc H2.
C. Tăng áp suất.
D. Tăng nhiệt độ.
Lời giải:
Đáp án đúng là: C
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất tức là chuyển dịch theo chiều giảm số mol khí. Như vậy, khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận (chuyển dịch sang phải).
Bài 1.6 trang 6 SBT Hóa 11: Cân bằng hoá học nào sau đây không bị chuyển dịch khi thay đổi áp suất?
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: D
Khi thay đổi áp suất, cân bằng không bị chuyển dịch khi tổng số mol khí ở chất phản ứng bằng tổng số mol khí ở sản phẩm.
Bài 1.7 trang 6 SBT Hóa 11: Cho cân bằng hoá học sau:
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Giảm nhiệt độ.
B. Tăng áp suất.
C. Giảm nồng độ của .
D. Thêm xúc tác Pt.
Lời giải:
Đáp án đúng là: A
< 0, vậy đây là phản ứng tỏa nhiệt.
Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều làm tăng nhiệt độ tức là chiều thuận (chuyển dịch sang phải).
A. .
B. .
C. .
D.
Lời giải:
Đáp án đúng là: C
Tại thời điểm cân bằng: = 4,84.10-3
Vậy cặp giá trị là phù hợp.
Bài 1.9 trang 7 SBT Hóa 11: Cho các phản ứng hoá học sau:
(1)
(2)
(3)
(4)
(5)
a) Các phản ứng toả nhiệt là
A. (1); (2) và (3).
B. (1) và (3).
C. (1), (2), (4) và (5).
D. (1); (2); (3) và (5).
b) Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3).
B. (1); (2) và (5).
C. (4) và (5).
D. (3) và (5).
c) Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3).
B. (1); (3) và (5).
C. (2); (3) và (4).
D. (3); (4) và (5).
Lời giải:
a) Đáp án đúng là: A
Phản ứng tỏa nhiệt là phản ứng có < 0.
Vậy các phản ứng tỏa nhiệt là (1); (2) và (3).
b) Đáp án đúng là: C
Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều thu nhiệt. Các phản ứng thu nhiệt là các phản ứng có > 0.Vậy đó là các phản ứng (4) và (5).
c) Đáp án đúng là: A
Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều làm giảm áp suất, tức là giảm số mol khí. Vậy các phản ứng chuyển dịch theo chiều thuận khi tăng áp suất là phản ứng (1); (2) và (3).
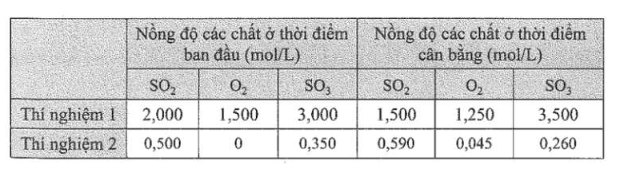
Lời giải:
Hằng số cân bằng của phản ứng là:
Thí nghiệm 1: Kc = 4,355;
Thí nghiệm 2: Kc = 4,315.
Nhận xét: Giá trị Kc ở hai thí nghiệm gần bằng nhau, mặc dù nồng độ các chất khác nhau.
Cân bằng hoá học của phản ứng trên sẽ chuyển dịch theo chiều nào nếu:
a) Tăng áp suất của bình phản ứng.
b) Tăng nhiệt độ của phản ứng.
c) Tăng nồng độ của C6H5CH2CH3.
d) Thêm chất xúc tác.
e) Tách styrene ra khỏi bình phản ứng.
Lời giải:
a) Tăng áp suất của bình phản ứng: Cân bằng chuyển dịch theo chiều nghịch là chiều làm giảm số mol khí.
b) Tăng nhiệt độ của phản ứng: Cân bằng chuyển dịch theo chiều thuận tức chiều phản ứng thu nhiệt.
c) Tăng nồng độ của C6H5CH2CH3: Cân bằng chuyển dịch theo chiều thuận, là chiều làm giảm nồng độ của C6H5CH2CH3.
d) Thêm chất xúc tác: Cân bằng không chuyển dịch. Chất xúc tác chỉ làm tăng tốc độ của cả phản ứng thuận và phản ứng nghịch, làm phản ứng nhanh đạt đến trạng thái cân bằng.
e) Tách styrene ra khỏi bình phản ứng: Cân bằng chuyển dịch theo chiều thuận, là chiều làm tăng nồng độ styrene.
Cho 0,75 mol PCl3 và 0,75 mol Cl2 vào bình kín dung tích 8 lít ở 227oC. Tính nồng độ các chất ở trạng thái cân bằng, biết giá trị hằng số cân bằng Kc ở 227oC là 49.
Lời giải:

Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
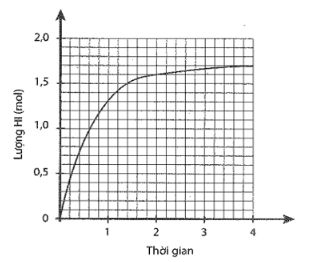
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.
Lời giải:
a) Số mol HI tại thời điểm cân bằng là 1,7 mol Số mol H2 và I2 phản ứng là 0,85 mol. Nồng độ các chất tại thời điểm cân bằng:
[H2] = [I2] = = 0,075 (mol/L)
[HI] = (mol/L)
b)
Lượng chất ban đầu : 1 1 0 (mol)
Lượng chất phản ứng: 0,85 0,85 1,7 (mol)
Nồng độ tại cân bằng: (mol/L)
Hằng số cân bằng (Kc):
c) Hiệu suất phản ứng: H%= 85%
NO khi được giải phóng ra không khí nhanh chóng kết hợp với O2 tạo thành NO2 là một khí gây ô nhiễm môi trường. Ở 2000oC, hằng số cân bằng Kc của phản ứng (1) là 0,01.
Nếu trong bình kín dung tích 1 lít có 4 mol N2 và 0,1 mol O2 thì ở 2000oC lượng khí NO tạo thành là bao nhiêu (giả thiết NO chưa phản ứng với O2 )?
Lời giải:
Phương trình phản ứng: N2(g) + O2(g) ⇌ 2NO(g)
Ban đầu: 4 0,1 0 (mol/L)
Cân bằng: 2x (mol/L)
Hằng số cân bằng
Vậy số mol khí NO tạo thành là: 2x.1 = 0,054 (mol)
Bài 1.15 trang 9 SBT Hóa 11: Trong dung dịch muối CoCl2 (màu hồng) tồn tại cân bằng hoá học sau:
màu hồng màu xanh
Dự đoán sự biến đổi màu sắc của ống nghiệm đựng dung dịch CoCl2 trong các trường hợp sau:
a) Thêm từ từ HCl đặc.
b) Ngâm ống nghiệm vào cốc nước nóng.
c) Thêm một vài giọt dung dịch AgNO3.
Lời giải:
Xét cân bằng:
màu hồng màu xanh
a) Thêm HCl: Cân bằng chuyển dịch theo chiều làm giảm nồng độ [Cl-], tức là chuyển dịch theo chiều thuận, dung dịch chuyển màu xanh.
b) Ngâm ống nghiệm vào cốc nước nóng: Cân bằng chuyển dịch theo chiều thuận (chiều thu nhiệt), dung dịch chuyển màu xanh.
c) Thêm một vài giọt dung dịch AgNO3: Ag+ + Cl- → AgCl (kết tủa trắng), nồng độ Cl- giảm, cân bằng chuyển dịch theo chiều nghịch, dung dịch màu hồng.
Xem thêm các bài giải SBT Hoá học 11 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.