Với giải Bài 1.13 trang 8 SBT Hóa 11 Kết nối tri thức chi tiết trong Bài 1: Khái niệm về cân bằng hoá học giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập Chuyên đề Tin học 11. Mời các bạn đón xem:
Trong một bình kín xảy ra cân bằng hoá học sau: H2(g) + I2(g) --- 2HI(g) cho 1 mol H2 và 1 mol I2
Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
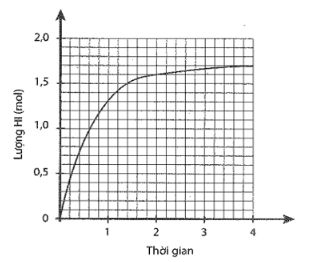
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.
Lời giải:
a) Số mol HI tại thời điểm cân bằng là 1,7 mol Số mol H2 và I2 phản ứng là 0,85 mol. Nồng độ các chất tại thời điểm cân bằng:
[H2] = [I2] = = 0,075 (mol/L)
[HI] = (mol/L)
b)
Lượng chất ban đầu : 1 1 0 (mol)
Lượng chất phản ứng: 0,85 0,85 1,7 (mol)
Nồng độ tại cân bằng:
(mol/L)
Hằng số cân bằng (Kc):
c) Hiệu suất phản ứng: H%= 85%
Xem thêm các bài giải SBT Hoá học 11 Kết nối tri thức hay, chi tiết khác:
Bài 1.1 trang 5 SBT Hóa 11: Phản ứng nào sau đây là phản ứng thuận nghịch?
Bài 1.2 trang 5 SBT Hóa 11: Cho 5 mol H2 và 5 mol I2 vào bình kín dung tích 1 lít và....
Bài 1.3 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau:
Bài 1.4 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau:
Bài 1.5 trang 6 SBT Hóa 11: Cho phản ứng hoá học sau:
Bài 1.6 trang 6 SBT Hóa 11: Cân bằng hoá học nào sau đây không bị chuyển dịch khi thay đổi áp suất?
Bài 1.7 trang 6 SBT Hóa 11: Cho cân bằng hoá học sau:
Bài 1.8 trang 7 SBT Hóa 11: Cho phản ứng hoá học sau: Phương án....
Bài 1.9 trang 7 SBT Hóa 11: Cho các phản ứng hoá học sau:
Bài 1.12 trang 8 SBT Hóa 11: Phosphorus trichloride (PCl3) phản ứng với chlorine (Cl2) tạo thành....
Bài 1.13 trang 8 SBT Hóa 11: Trong một bình kín xảy ra cân bằng hoá học sau:
Bài 1.15 trang 9 SBT Hóa 11: Trong dung dịch muối CoCl2 (màu hồng) tồn tại cân bằng hoá học sau:
Xem thêm các bài giải SBT Hoá học 11 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.