Toptailieu.vn biên soạn và giới thiệu lời giải SBT Hóa 11 (Kết nối tri thức) Bài 2: Cân bằng trong dung dịch nước hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi từ đó học tốt môn Hoá học 11.
Nội dung bài viết
SBT Hóa 11 (Kết nối tri thức) Bài 2: Cân bằng trong dung dịch nước
A. pH giảm đi 2 đơn vị.
B. pH giảm đi 1 đơn vị.
C. pH tăng 2 đơn vị.
D. pH tăng gấp đôi.
Lời giải:
Đáp án đúng là: A
Khi tăng thể tích lên 100 lần thì nồng độ ion OH- trong dung dịch giảm 100 lần
nồng độ H+ tăng 100 lần pH = -log[H+] pH giảm 2 lần.
A. 0,01.
B. 0,02.
C. 0,05.
D. 0,005.
Lời giải:
Đáp án đúng là: D
Theo định luật bảo toàn điện tích có:
2.0,01 + 0,01 = 0,02 + 2.x
x = 0,005.
A. KNO3.
B. K2SO4.
C. Na2CO3.
D. NaCl.
Lời giải:
Đáp án đúng là: C
CO32- là gốc acid yếu nên bị thủy phân tạo môi trường base
CO2−3 +H2O ⇌ HCO−3 +OH−
A. HF.
B. HCl.
C. HBr.
D. HI.
Lời giải:
Đáp án đúng là: A
Dung dịch acid càng yếu thì pH càng cao.
Độ mạnh của acid giảm dần theo dãy sau: HI > HBr > HCl > HF.
A. Nồng độ ion H+ dung dịch nước mưa bị ô nhiễm là 10-4,5.
B. Nồng độ ion H+ trong dung dịch nước mưa không bị ô nhiễm là 10-5,7.
C. Nồng độ ion H+ trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
D. Nồng độ ion OH- trong nước mưa bị ô nhiễm thấp hơn hơn so với trong nước mưa không bị ô nhiễm.
Lời giải:
Đáp án đúng là: C
Nồng độ ion H+ trong nước mưa bị ô nhiễm là [H+] = - log[H+] = 10-4,5.
Nồng độ ion H+ trong nước mưa không bị ô nhiễm là [H+] = - log[H+] = 10-5,7.
Vậy nồng độ H+ trong nước mưa không bị ô nhiễm thấp hơn so với trong nước mưa bị ô nhiễm.
Bài 2.6 trang 10 SBT Hóa 11: Viết phương trình điện li của các chất sau:
- Acid yếu: HCOOH, HCN; acid mạnh: HCl, HNO3.
- Base mạnh: KOH, Ba(OH)2 ; base yếu: Cu(OH)2.
- Muối: KNO3, Na2CO3, FeCl3.
Lời giải:
Phương trình điện li các chất:
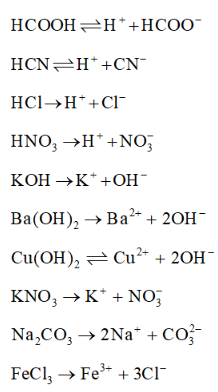
a) HCOOH+H2O⇌HCOO−+H3O+
b) HCN+H2O⇌CN−+H3O+
c) S2−+H2O⇌HS−+OH−
d) (CH3)2NH+H2O⇌(CH3)2NH+2+OH−
Lời giải:
a) HCOOH+H2O⇌HCOO−+H3O+
Phản ứng thuận: HCOOH là acid, H2O là base; phản ứng nghịch: HCOO- là base, H3O+ là acid.
b) HCN+H2O⇌CN−+H3O+
Phản ứng thuận: HCN là acid, H2O là base; phản ứng nghịch: CN- là acid, H3O+ là base.
c) S2−+H2O⇌HS−+OH−
Phản ứng thuận: H2O là acid, S2- là base; phản ứng nghịch: HS- là acid, là OH- base.
d) (CH3)2NH+H2O⇌(CH3)2NH+2+OH−
Phản ứng thuận: H2O là acid, (CH3)2NH là base; phản ứng nghịch: (CH3)2NH2+ là acid, OH- là base.
a) Lấy 10 mL dung dịch A, thêm nước để được 100 mL. Tính pH của dung dịch sau khi pha loãng.
b) Lấy 10 mL dung dịch B, thêm nước để được 100 mL. Tính pH của dung dịch sau khi pha loãng.
Lời giải:
a) Nồng độ của dung dịch A sau khi pha loãng là: 1.0,1 = 0,1M.
⇒ [H+] = 0,1M ⇒ pH của dung dịch sau khi pha loãng là 1,0.
b) Nồng độ của dung dịch B sau khi pha loãng là: 1.0,1 = 0,1M.
⇒ [OH-] = 0,1M ⇒ [H+] = 10-13 ⇒pH của dung dịch sau khi pha loãng là 13,0.
Bài 2.9 trang 11 SBT Hóa 11: Một dung dịch baking soda có pH = 8,3.
a) Môi trường của dung dịch trên là acid, base hay trung tính?
b) Tính nồng độ ion H+ của dung dịch trên.
Lời giải:
a) Môi trường của dung dịch là base (pH > 7).
b) Nồng độ của ion H+ là 10-8,3.
Lời giải:
pH= -log [H+] [H+] = 10-pH.
Nồng độ của ion H+ = 10-2,8; nồng độ của ion OH- là
[OH-] =10−14[H+]=10−1410−2,8=10−11,2 .
a) Tính nồng độ Ca(OH)2 trong dung dịch nước vôi trong.
b) Tính lượng CaO đã bị hoà tan.
c) Tính pH của dung dịch nước vôi trong.
Lời giải:
CaO + H2O → Ca(OH)2
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
a) CM(Ca(OH)2)=12,1.10−3.0,15.10−3.2=0,121(M)
b) Số mol HCl dùng để chuẩn độ 5 mL dung dịch A là:
nHCl = 12,1.10-3.0,1 = 12,1 .10-4 (mol) Số mol Ca(OH)2 có trong 5 mL dung dịch
A là (mol) nCa(OH)2= 12,1.10−42=6,05.10−4 số mol Ca(OH)2 có trong 500 mL dung dịch A là nCa(OH)2 = 6,05.10-2 (mol)
nCaO=nCa(OH)2=6,05.10−2 (mol) mCaO = 56 . 6,05.10-2 = 3,388 (g).
c) Số mol của Ca(OH)2 có trong 500 mL dung dịch nước vôi trong là:
nCa(OH)2 = 6,05 . 10-2 (mol) nOH−=2nCa(OH)2=0,121 (mol)
⇒[OH−]=0,1210,5=0,242 M ⇒[H+]=10−140,242=4,132.10−14 M
pH = -log[H+] = 13,38.
Lấy 1,0 g vỏ trứng khô, đã được làm sạch, hoà tan hoàn toàn trong 50 mL dung dịch HCl 0,4 M. Lọc dung dịch sau phản ứng thu được 50 mL dung dịch A. Lấy 10,0 mL dung dịch A chuẩn độ với dung dịch NaOH 0,1 M thấy hết 5,6 mL. Xác định hàm lượng calcium trong vỏ trứng (giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl).
Lời giải:

a) Viết phương trình hoá học của phản ứng trung hoà trên.
b) Giả thiết nồng độ dung dịch HCl trong dạ dày là 0,035 M, tính thể tích dung dịch HCl được trung hoà khi bệnh nhân uống 0,588 g bột NaHCO3.
Lời giải:
a) Phương trình hóa học:
NaHCO3 + HCl → NaCl + H2O + CO2
b) Số mol NaHCO3 là nNaHCO3=0,58884=7.10−3(mol)
Số mol HCl có trong dạ dày là nHCl = 7.10-3 (mol).
Vậy thể tích dung dịch HCl được trung hòa là:
VHCl = 7.10−30,035=0,2 (l)=200 mL.
Lời giải:
Phương trình hóa học:
NH3 + HCl → NH4Cl
HCldư + NaOH → NaCl + H2O
Số mol HCl ban đầu là: nHCl = 10.10-3.0,2 = 2.10-3 (mol)
Số mol HCl dư = số mol NaOH phản ứng = 10,2.10-3.0,1=1,02.10-3 (mol)
Số mol HCl phản ứng với NH3 là:
nHCl = nHCl ban đầu - nHCl dư = 2.10-3 – 1,02.10-3 = 0,98.10-3 (mol)
Vậy số mol NH3 = 0,98.10-3 (mol)
Nồng độ của dung dịch NH3 đã dùng là: CM(NH3) =0,98.10−35.10−3=0,196 M
Xem thêm các bài giải SBT Hóa 11 Kết nối tri thức hay, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.