Với giải Bài 3.8 trang 17 SBT Hóa 11 Chân trời sáng tạo chi tiết trong Bài 3: Đơn chất nitrogen giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập Hoá học 11. Mời các bạn đón xem:
Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong
Bài 3.8 trang 17 SBT Hóa học 11: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
Lời giải:
+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
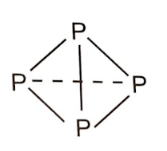
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 3.1 trang 16 SBT Hóa học 11: Ở trạng thái tự nhiên, nitrogen
Bài 3.2 trang 16 SBT Hóa học 11: Cấu hình electron nguyên tử của nitrogen là
Bài 3.3 trang 16 SBT Hóa học 11: Tính chất nào sau đây của nitrogen không đúng?
Bài 3.4 trang 16 SBT Hóa học 11: Nitrogen trong không khí có vai trò nào sau đây?
Bài 3.6 trang 17 SBT Hóa học 11: Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.
Bài 3.7 trang 17 SBT Hóa học 11: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol...
Bài 3.8 trang 17 SBT Hóa học 11: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở...
Bài 3.9 trang 17 SBT Hóa học 11: Xác định cụm từ phù hợp trong các ô từ (1) đến (7) để hoàn...
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.