Toptailieu.vn giới thiệu Giải bài tập Hóa học 9 Bài 9: Tính chất hóa học của muối chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất hóa học của muối lớp 9.
Giải bài tập Hóa học 9 Bài 9: Tính chất hóa học của muối
Bài tập trang 33 SGK Hóa học 9
Bài 1 trang 33 SGK Hóa học 9: Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:
a) Chất khí; b) Chất kết tủa.
Viết phương trình hóa học.
Phương pháp giải
a) Muối tác dụng với 1 chất tạo ra chất khí => chọn các muối cacbonat hoặc muối sunfit tác dụng với axit mạnh.
b) Ta dựa vào bảng tính tan của muối để chọn các muối không tan (BaSO4, AgCl, BaCO3…) hoặc bazơ không tan, từ đó tìm ra muối và chất tham gia phản ứng còn lại
Lời giải
a) Tạo ra chất khí, ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3) hoặc dung dịch muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng):
CaCO3 + H2SO4 CaSO4 + CO2 + H2O
Na2CO3 + 2HCl 2NaCl + CO2 + H2O
Na2SO3 + H2SO4 Na2SO4 + SO2 + H2O
b) Tạo chất kết tủa, ví dụ dung dịch muối (BaCl2, Ba(CH3COO)2, Ba(NO3)2,…) tác dụng với dung dịch H2SO4 tạo kết tủa BaSO4.
BaCl2 + H2SO4 BaSO4 + 2HCl
Ba(CH3COO)2 + H2SO4 BaSO4 + 2CH3COOH
Hoặc những dung dịch muối bari tác dụng với dung dịch muối cacbonat (Na2CO3, K2CO3) tạo ra BaCO3 kết tủa.
Ba(NO3)2 + Na2CO3 BaCO3 + 2NaNO3
Bài 2 trang 33 SGK Hóa học 9: Có 3 lọ không nhãn, mỗi lọ đựng một dung dịch muối: CuSO4, AgNO3, NaCl. Hãy dùng những dung dịch có sẵn trong phòng thí nghiệm để nhận biết chất đựng trong mỗi lọ. Viết các phương trình hóa học.
Phương pháp giải
Gợi ý: Dùng dung dịch NaOH để nhận biết
Lời giải
Cách 1:
Cho dung dịch NaOH vào ba ống nghiệm chứa các muối trên
+ Chất trong ống nghiệm nào cho kết tủa màu xanh lam là CuSO4
+ Chất trong ống nghiệm cho kết tủa trắng sau chuyển thành màu đen là AgNO3
+ Chất trong ống nghiệm còn lại không có hiện tượng gì là NaCl.
Phương trình phản ứng:
CuSO4 + 2NaOH ⟶ Cu(OH)2↓ + Na2SO4
2AgNO3 + 2NaOH ⟶ Ag2O↓ + 2NaNO3 + H2O.
Cách 2:
Trích mẫu thử và đánh số thứ tự
- Dùng dung dịch NaCl có sẵn trong phòng thí nghiệm lần lượt cho vào từng mẫu thử trên:
+ Có kết tủa trắng xuất hiện đó là sản phẩm của AgNO3
NaCl + AgNO3 AgCl + NaNO3
+ Không có hiện tượng gì là CuSO4 và NaCl
- Dùng dung dịch NaOH có trong thí nghiệm, cho vào 2 mẫu còn lại
+ mẫu nào có kết tủa đó là sản phẩm của CuSO4
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
+ Còn lại là NaCl
Bài 3 trang 33 SGK Hóa học 9: Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Hãy cho biết muối nào có thể tác dụng với:
a) Dung dịch NaOH;
b) Dung dịch HCl;
c) Dung dịch AgNO3.
Nếu có phản ứng, hãy viết các phương trình hóa học.
Phương pháp giải
Điều kiện để muối tác dụng được với dung dịch axit hay dung dịch bazo, hay muối là tạo ra được chất kết tủa hoặc chất bay hơi.
Lời giải
a) Cả hai muối tác dụng với dung dịch NaOH vì sản phẩm tạo thành có Mg(OH)2, Cu(OH)2 không tan,
Mg(NO3)2 +2NaOH→2NaNO3 + Mg(OH)2↓
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
b) Không có muối nào tác dụng với dung dịch HCl vì không có chất kết tủa hay chất khí tạo thành.
c) Chỉ có muối CuCl2 tác dụng với dung dịch AgNO3 vì sản phẩm tạo thành có AgCl không tan.
CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
Bài 4 trang 33 SGK Hóa học 9: Cho những dung dịch muối sau đây phản ứng với nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng, dấu (o) nếu không.
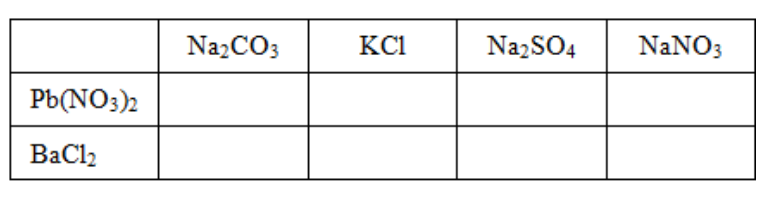 Viết phương trình hóa học ở ô có dấu (x).
Viết phương trình hóa học ở ô có dấu (x).
Phương pháp giải
Điều kiện: 2 muối tác dụng với nhau sản phẩm tạo ra có chất kết tủa
Lời giải
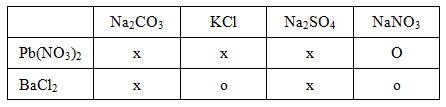
Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → 2NaNO3 + PbCO3↓
Pb(NO3)2 + 2KCl → 2KNO3 + PbCl2↓
Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4↓
BaCl2 + Na2CO3 → 2NaCl + BaCO3↓
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
Bài 5 trang 33 SGK Hóa học 9: Ngâm một đinh sắt sạch trong dung dịch đồng (II) sunfat. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được?
a) Không có hiện tượng nào xảy ra.
b) Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không có sự thay đổi.
c) Một phần đinh sắt bị hòa tan, kim loại đồng bám ngoài đinh sắt và màu xanh lam của dung dịch ban đầu nhạt dần.
d) Không có chất mới nào được sinh ra, chỉ có một phần đinh sắt bị hòa tan.
Giải thích cho sự lựa chọn và viết phương trình hóa học nếu có.
Lời giải chi tiết
Câu c đúng
Fe + CuSO4 → FeSO4 + Cu↓
Khi cho đinh sắt vào dung dịch CuSO4, đinh sắt bị hòa tan, kim loại đồng bám ngoài đinh sắt, dung dịch CuSO4 tham gia phản ứng (tạo nên FeSO4) nên màu xanh của dung dịch ban đầu bị nhạt dần.
Bài 6 trang 33 SGK Hóa học 9
Trộn 30 ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 1,7g AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
Phương pháp giải
a) Dựa vào chất sau phản ứng có kết tủa hay không kết tủa, màu sắc như thế nào => nêu được hiện tượng.
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓
b) Tính số mol CaCl2 =? ; nAgNO3 = ?
Dựa vào phương trình hóa học xem chất nào phản ứng hết, chất nào còn dư. Mọi tính toán theo chất phản ứng hết.
c) Công thức CM = n: V
Lời giải chi tiết
Phương trình phản ứng
a) Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là
b)
c)
Dung dịch sau phản ứng thay đổi không đáng kể nên thể tích dung dịch sau phản ứng coi như bằng thể tích dung dich trước phản ứng.
Dung dịch sau phản ứng có chứa dư và
Do vậy ta có
Lý thuyết Tính chất hóa học của muối
I. Tính chất hóa học của muối
1. Tác dụng với kim loại → muối mới + kim loại mới
- Điều kiện: Kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối
Thí dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Tác dụng với axit → muối mới + axit mới
* Điều kiện xảy ra phản ứng: sản phẩm tạo thành phải có chất khí hoặc chất kết tủa hoặc nước
Thí dụ:
BaCl2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + ↑ + H2O
3. Tác dụng với dung dịch muối → 2 muối mới
* Điều kiện xảy ra phản ứng: sản phẩm tạo thành phải có chất khí hoặc chất kết tủa hoặc nước
Thí dụ:
AgNO3 + NaCl → NaNO3 + AgCl↓
4. Tác dụng với dung dịch bazơ → muối mới + bazơ mới
* Điều kiện xảy ra phản ứng: sản phẩm tạo thành phải có chất khí hoặc chất kết tủa hoặc nước
Thí dụ:
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
5. Phản ứng phân hủy muối
- Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Thí dụ:
2KClO3 2KCl + 3O2
CaO + CO2
II. Phản ứng trao đổi trong dung dịch
1. Định nghĩa: Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Thí dụ:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Phản ứng không xảy ra.
- Chú thích: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
Thí dụ:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Sơ đồ tư duy: Tính chất hóa học của muối
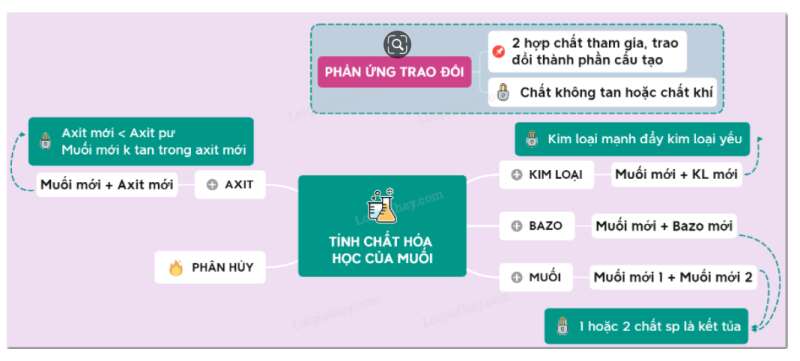 Phương pháp giải một số dạng bài tập về muối
Phương pháp giải một số dạng bài tập về muối
Dạng 1
Bài tập lý thuyết về muối
* Một số lưu ý cần nhớ
Tính chất hóa học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Thí dụ: Fe + CuSO4 → FeSO4 + Cu↓
2. Tác dụng với axit
Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Thí dụ: BaCl2 + H2SO4 → 2HCl + BaSO4↓
3. Tác dụng với dung dịch muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Thí dụ: AgNO3 + NaCl → NaNO3 + AgCl↓
4. Tác dụng với dung dịch bazơ
Dung dịch bazơ có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Thí dụ: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
5. Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
CaO + CO2
Phản ứng trao đổi trong dung dịch
1. Định nghĩa: Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Thí dụ: CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
Chú thích: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
Thí dụ: H2SO4 + 2NaOH → Na2SO4 + 2H2O
* Một số ví dụ điển hình
Ví dụ 1: Trong các dung dịch sau, chất nào phản ứng được với dung dịch BaCl2 ?
A. AgNO3
B. HCl
C. HNO3
D. NaNO3
Hướng dẫn giải:
Điều kiện để muối phản ứng được với dd axit hay muối khác là: sản phẩm tạo thành có chất kết tủa hoặc bay hơi ; hoặc axit tạo thành yếu hơn axit tham gia phản ứng.
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
Đáp án A
Ví dụ 2: Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
A. CO2, NaOH, H2SO4, Fe
B. H2SO4, AgNO3, Ca(OH)2, Al
C. NaOH, BaCl2, Fe, H2SO4
D. NaOH, BaCl2, Fe, Al
Hướng dẫn giải:
Dung dịch CuSO4 phản ứng được với: NaOH, BaCl2, Fe, Al
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
CuSO4 + Fe → FeSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Đáp án D
Dạng 2
* Một số lưu ý cần nhớ
Axit + muối Muối mới => Muối mới + axit mới
Sản phẩm sau phản ứng phải có ít 1 chất là : chất kết tủa, chất khí hoặc nước.
VD: HCl + CaCO3 → CaCl2 + CO2 + H2O
* Một số ví dụ điển hình
Ví dụ 1: Cho a gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở đktc. Giá trị của a là
Hướng dẫn giải:
Phương trình hóa học: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Theo phương trình hóa học:
Ví dụ 2: Khi cho 200 gam dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra là
Hướng dẫn giải:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
0,2 mol → 0,2 mol
Dạng 3
Bài toán về dung dịch bazo tác dụng với dung dịch muối
* Một số lưu ý cần nhớ
Dung dịch bazo + Dung dịch muối => Muối mới + Bazo mới
Điều kiện để xảy ra phản ứng là:
+ Chất tham gia phản ứng phải là chất tan
+ Sản phẩm phải có ít nhất 1 trong các loại chất sau: chất kết tủa, chất khí, hoặc nước.
* Một số ví dụ điển hình
Ví dụ 1: Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
Hướng dẫn giải:
Phương trình hóa học: CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
Xét tỉ lệ:
=> CuSO4 phản ứng hết, NaOH còn dư => phản ứng tính theo CuSO4
Ta có:
Nung chất rắn đến khối lượng không đổi:
Cu(OH)2 CuO + H2O
0,1 mol → 0,1 mol
=> mCuO = 0,1.80 = 8 gam
Ví dụ 2: Cho 200g dung dịch Ba(OH)2 17,1% vào 500g dung dịch hỗn hợp (NH4)2SO4 1,32% và CuSO4 2%. Sau khi kết thúc tất cả các phản ứng ta thu được khí A, kết tủa B và dung dịch C.
a/ Tính thể tích khí A (đktc)
b/ Lấy kết tủa B rửa sạch và nung ở nhiệt cao đến khối lượng không đổi thì được bao nhiêu gam rắn?
c/ Tính nồng độ % của các chất trong C.
Hướng dẫn giải:
a/ Khí A là NH3 có thể tích là 2,24 lit
b/ Khối lượng BaSO4 = 0,1125 . 233 = 26,2g và mCuO = 0,0625 . 80 = 5g
c/ Khối lượng Ba(OH)2 dư = 0,0875 . 171 = 14,96g
mdd = Tổng khối lượng các chất đem trộn - mkết tủa - mkhí
mdd = 500 + 200 – 26,21 – 6,12 – 1,7 = 666g
Nồng độ % của dung dịch Ba(OH)2 = 2,25%
Dạng 4
Bài toán về phản ứng giữa các dung dịch muối
* Một số lưu ý cần nhớ
Dung dịch muối 1 + Dung dịch muối 2 => 2 muối mới
Điều kiện để phản ứng có thể xảy ra được là:
+ Chất tham gia phản ứng phải tan
+ Sản phẩm phải có ít nhất 1 chất là: Chất kết tủa, chất khí hoặc nước
* Một số ví dụ điển hình
Ví dụ 1: Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
Hướng dẫn giải chi tiết:
NaCl + AgNO3 → AgCl↓ + NaNO3
Xét tỉ lệ: => NaCl hết, AgNO3 dư
=> phản ứng tính theo NaCl
Theo phương trình:
Dạng 5
Bài toán nhiệt phân muối
* Một số lưu ý cần nhớ
Một số muối có khả năng bị nhiệt phân khi gặp nhiệt độ cao
VD: KNO3 → KNO2 + ½ O2
CaCO3 → CaO + CO2
* Một số ví dụ điển hình
Ví dụ 1: Trong phòng thí nghiệm, người ta thường dùng muối KNO3 để điều chế khí oxi bằng phản ứng phân hủy. Để điều chế 1,12 lít khí O2 (đktc) thì khối lượng muối cần dùng là
Hướng dẫn giải:
PTHH: 2KNO3 2KNO2 + O2
Theo phương trình:
Ví dụ 2: Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
Hướng dẫn giải:
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y mol
=> mhỗn hợp = 100x + 84y = 14,2 (1)
Phương trình hóa học:
CaCO3 CaO + CO2
x mol → x mol
MgCO3 MgO + CO2
y mol → y mol
Từ (1) và (2) => x = 0,1 mol; y = 0,05 mol
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.