Toptailieu.vn giới thiệu Giải bài tập Hóa học 9 Bài 7: Tính chất hóa học của bazơ chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất hóa học của bazơ lớp 9.
Giải bài tập Hóa học 9 Bài 7: Tính chất hóa học của bazơ
Bài tập trang 25 SGK Hóa học 9
Bài 1 trang 25 SGK Hóa học 9: phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của ba chất để minh họa.
Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của ba chất để minh họa.
Lời giải
- Vì kiềm là một loại bazơ tan được trong nước nên tất cả các chất kiềm đều là bazơ.
Thí dụ: NaOH, KOH, Ba(OH)2.
- Vì không phải mọi bazơ đều tan trong nước nên không phải tất cả các bazơ đều là chất kiềm.
Thí dụ: Các bazơ Cu(OH)2,Mg(OH)2, Fe(OH)3 .. là các bazơ không tan
Bài 2 trang 25 SGK Hóa học 9: Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào
a) Tác dụng được với với dung dịch HCl.
b) Bị nhiệt phân hủy.
c) Tác dụng được CO2.
d) Đổi màu quỳ tím thành xanh.
Phương pháp giải
a) Tất cả các bazơ đều tác dụng với axit
b) Chỉ có các bazơ không tan mới bị nhiệt phân hủy
c) Chỉ có các bazơ tan mới tác dụng được với CO2.
d) Chỉ có các bazơ tan mới đổi màu quỳ tím thành xanh.
Lời giải
a) Tất cả các bazơ đều tác dụng với axit HCl:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
b) Chỉ có Cu(OH)2 là bazơ không tan nên bị nhiệt phân hủy:
Cu(OH)2 CuO + H2O
c) Những bazơ tác dụng với CO2 là NaOH và Ba(OH)2.
2NaOH + CO2 → Na2CO3 + H2O
CO2 + NaOH NaHCO3
Ba(OH)2 + CO2 → BaCO3 + H2O
2CO2 + Ba(OH)2 Ba(HCO3)2
d) Những bazơ đổi màu quỳ tím thành màu xanh là NaOH và Ba(OH)2.
Bài 3 trang 25 SGK Hóa học 9: Từ những chất có sẵn là Na2O, CaO, H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
Phương pháp giải
Điều chế các dung dịch bazơ tương ứng là NaOH, Ca(OH)2
Lời giải
Phương trình hóa học điều chế các dung dịch bazơ:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài 4 trang 25 SGK Hóa học 9: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
Phương pháp giải
- Cho quỳ tím vào từng mẫu thử của các dung dịch trên, rồi chia làm hai nhóm:
+ Nhóm 1: Quỳ tím đổi màu thành xanh: Ba(OH)2 và NaOH.
+ Nhóm 2: Quỳ tím không đổi màu: NaCl và Na2SO4.
– Phân biệt các chất trong các nhóm: Lấy từng chất của nhóm 1 đổ vào từng chất của nhóm 2
Quan sát hiện tượng => rút ra chất đem đổ và chất bị đổ => phân biệt được từng chất.
Lời giải chi tiết
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
- Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
Bài 5 trang 25 SGK Hóa học 9: Cho 15,5 gam natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Phương pháp giải
- Đổi số mol Na2O
- Viết PTHH: Na2O + H2O → 2NaOH
Tính toán theo PTHH
a) Công thức tính nồng độ mol/lít CM = n : V
b)
Lời giải
a) Phương trình hóa học:
Ta có:
b) Phương trình hóa học:
Lý thuyết tính chất hóa học của bazơ
I. Phân loại bazơ
Dựa vào tính tan của bazơ trong nước, người ta chia tính bazơ thành 2 loại:
- Bazơ tan được trong nước tạo thành dung dịch bazơ (gọi là kiềm):
NaOH, KOH, Ba(OH)2, Ca(OH)2, LiOH, RbOH, CsOH, Sr(OH)2.
- Những bazơ không tan trong nước:
Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
II. Tính chất hóa học của bazơ
1. Tác dụng với chất chỉ thị màu.
- Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
- Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2. Dung dịch bazơ + oxit axit → muối + nước.
Thí dụ:
2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3()2↓ + 3H2O
3) Bazơ (tan và không tan) + axit → muối + nước.
Thí dụ:
KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
4) Dung dịch bazơ tác dụng với nhiều dung dịch muối → muối mới + bazơ mới.
Thí dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
5) Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Thí dụ:
Cu(OH)2 CuO + H2O
2Fe(OH)3 Fe2O3 + 3H2O
Sơ đồ tư duy: Tính chất hóa học của bazo
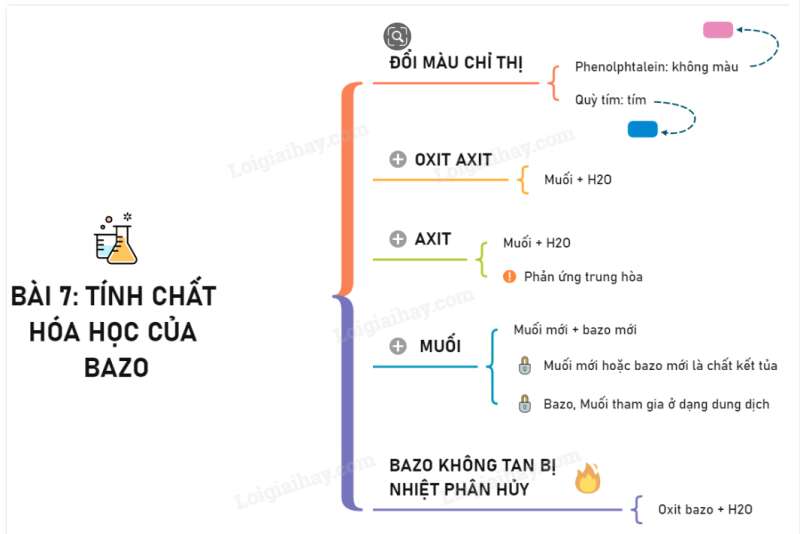
Phương pháp giải một số dạng bài tập về tính chất hóa học của bazo
Dạng 1
Lý thuyết về tính chất hóa học của bazo
* Một số lưu ý cần nhớ
Dựa vào tính tan của bazơ trong nước, người ta chia tính bazơ thành 2 loại:
- Bazơ tan được trong nước tạo thành dung dịch bazơ (gọi là kiềm):
NaOH, KOH, Ba(OH)2, Ca(OH)2, LiOH, RbOH, CsOH, Sr(OH)2.
- Những bazơ không tan trong nước:
Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
* Tính chất hóa học của bazơ
1) Tác dụng với chất chỉ thị màu.
- Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
- Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2) Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Thí dụ: 2NaOH + SO2 → Na2SO3 + H2O
3) Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Thí dụ: KOH + HCl → KCl + H2O
4) Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Thí dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
5) Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Thí dụ: Cu(OH)2 CuO + H2O
* Một số ví dụ điển hình
Ví dụ 1: Dung dịch nào sau đây làm quỳ tím chuyển sang màu xanh?
A. HCl
B. MgCl2
C. Ca(OH)2
D. H2SO4
Hướng dẫn giải:
Ca(OH)2 là dd bazơ => làm quỳ tím chuyển sang màu xanh
Đáp án C
Ví dụ 2: Nhiệt phân sắt (III) hiđroxit thu được sản phẩm là:
A. Fe2O3
B. FeO và H2O
C. Fe2O3 và H2O
D. Fe và H2O
Hướng dẫn giải:
2Fe(OH)3 Fe2O3 + 3H2O
Đáp án C
Ví dụ 3: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ cần dùng thêm 1 hóa chất nào sau đây để nhận biết các dung dịch trên?
A. quỳ tím
B. dung dịch HCl
C. dung dịch BaCl2
D. dung dịch KOH
Hướng dẫn giải:
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
- Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH
Đáp án A
Dạng 2
Dung dịch bazo tác dụng với kim loại
* Một số lưu ý cần nhớ:
Một số dung dịch bazo có khả năng tác dụng với KL (Al, Zn, ...)
VD: Al + NaOH + H2O → NaAlO2 + 3/2 H2
Zn + 2NaOH → Na2ZnO2 + H2
Để làm được loại bài tập này, em cần
- viết đúng phương trình hóa học
- tính số mol, lượng chất đề bài cho
- dựa vào phương trình hóa học, áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố để giải bài toán
* Một số ví dụ điển hình
Ví dụ 1: Cho 11,8 gam hỗn hợp X gồm Al và Cu vào dung dịch NaOH (loãng, dư). Khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít khí H2 (đktc). Khối lượng của Cu trong hỗn hợp X là
Hướng dẫn giải:
Khi cho hỗn hợp X gồm Al và Cu vào dung dịch NaOH loãng dư thì chỉ có Al phản ứng.
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Ta có: nAl = 2/3.nH2 = 2/3.0,3 = 0,2 (mol) → mCu = mX - mAl = 11,8 - 0,2. 27 = 6,4 (g)
Ví dụ 2: Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 6,72 lít khí (đktc). Thể tích dung dịch NaOH cần dùng là
Hướng dẫn giải:
nH2(đktc) = VH2/22,4 = 6,72/22,4 = 0,3 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,2 ← 0,3
Theo PTHH: nNaOH = 2/3 nH2 =2/3×0,3 =0,2 (mol)
→ VNaOH = nNaOH : CM = 0,2 : 1 = 0,2 (lít) = 200 (ml)
Dạng 3
Phản ứng nhiệt phân của bazo không tan
* Một số lưu ý cần nhớ:
Ta có phương trình tổng quát:
2M(OH)n ..M2On + nH2O
Để làm được loại bài tập này, em cần
- viết đúng phương trình hóa học
- tính số mol, lượng chất đề bài cho
- dựa vào phương trình hóa học, áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố để giải bài toán
Một số ví dụ điển hình:
Ví dụ 1: Nhiệt phân hoàn toàn x gam Fe(OH)3 đến khối lượng không đổi thu được 24 gam chất rắn. Giá trị bằng số của x là:
Hướng dẫn giải:
2Fe(OH)3 Fe2O3 + 3H2O
Tỉ lệ 2 1
Pứ ?mol 0,15 mol
Từ pt =>
Ví dụ 2: Nhiệt phân hoàn toàn 19,6g Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
Hướng dẫn giải;
nCu(OH)2 = 19,6 : (64 + 2 + 32) = 0,2 mol
Cu(OH)2 CuO + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => nCuO = nCu(OH)2 = 0,2 mol
CuO + H2 Cu + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => nCu = nCuO= 0,2 mol
=> mCu = nCu . MCu = 0,2 . 64 = 12,8g
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.