Với giải Bài 2.21 trang 13 SBT Hóa 11 Chân trời sáng tạo chi tiết trong Bài 2: Cân bằng trong dung dịch nước giúp học sinh dễ dàng xem và so sánh lời giải, từ đó biết cách làm bài tập Hoá học 11. Mời các bạn đón xem:
Trong phương pháp chuẩn độ acid – base, xung quanh điểm tương đương có một sự thay đổi pH
Bài 2.21 trang 13 SBT Hóa học 11: Trong phương pháp chuẩn độ acid – base, xung quanh điểm tương đương có một sự thay đổi pH đột ngột gọi là bước nhảy chuẩn độ. Đường biểu diễn trên đồ thị chuẩn độ acid – base gọi là đường định phân. Từ các số liệu sau đây, hãy vẽ đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH 0,100 M. Trục hoành ghi thể tích dung dịch NaOH, trục tung ghi pH của dung dịch. Xác định giá trị điểm tương đương và khoảng bước nhảy chuẩn độ của quá trình này.
|
VNaOH (mL) |
Giá trị pH |
VNaOH (mL) |
Giá trị pH |
|
0,0 |
1,00 |
25,1 |
10,30 |
|
5,0 |
1,18 |
25,5 |
11,00 |
|
10,0 |
1,37 |
26,0 |
11,29 |
|
15,0 |
1,60 |
28,0 |
11,75 |
|
20,0 |
1,95 |
30,0 |
11,96 |
|
22,0 |
2,20 |
35,0 |
12,22 |
|
24,0 |
2,69 |
40,0 |
12,36 |
|
24,5 |
3,00 |
45,0 |
12,46 |
|
24,9 |
3,70 |
50,0 |
12,52 |
|
25,0 |
7,00 |
|
|
Lời giải:
- Đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH 0,100 M:
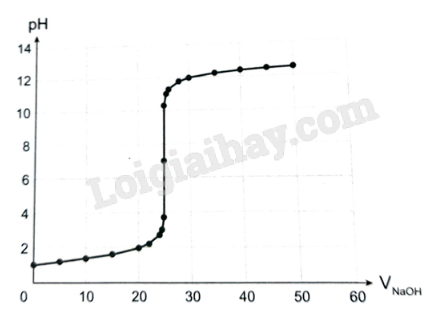
- Chuẩn độ HCl (acid mạnh) bằng NaOH (base mạnh):
+ Tại điểm tương đương, [H+] = [OH-]; pH = 7.
+ Bước nhảy chuẩn độ: ở khoảng pH từ 3,7 đến 10,3.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 2.1 trang 11 SBT Hóa học 11: Vì sao dung dịch của các muối, acid, base dẫn điện?
Bài 2.2 trang 11 SBT Hóa học 11: Dung dịch sodium chloride (NaCl) dẫn được điện là do
Bài 2.3 trang 11 SBT Hóa học 11: Saccharose là chất không điện li vì
Bài 2.4 trang 11 SBT Hóa học 11: Phát biểu nào sau đây đúng khi nói về sự điện li?
Bài 2.5 trang 11 SBT Hóa học 11: Các chất trong dãy nào sau đây là những chất điện li mạnh?
Bài 2.6 trang 12 SBT Hóa học 11: Phương trình diện là nào sau đây biểu diễn không đúng?
Bài 2.7 trang 12 SBT Hóa học 11: Phương trình diện là nào sau đây biểu diễn đúng?
Bài 2.8 trang 12 SBT Hóa học 11: Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong (1) ...
Bài 2.9 trang 12 SBT Hóa học 11: Cho các chất sau: glucose (C6H12O6), NaCl, KOH, Ba(OH)2....
Bài 2.10 trang 12 SBT Hóa học 11: Viết phương trình điện li của các chất sau trong nước: HBr...
Bài 2.11 trang 12 SBT Hóa học 11: Tính nồng độ mol của các ion trong các dung dịch sau:
Bài 2.12 trang 12 SBT Hóa học 11: Khả năng dẫn điện của nước vôi trong (dung dịch Ca(OH)2...
Bài 2.13 trang 12 SBT Hóa học 11: Trong các phản ứng dưới đây, hãy cho biết ở phản ứng nào...
Bài 2.14 trang 12 SBT Hóa học 11: Cho các phân tử và ion sau:...
Bài 2.15 trang 13 SBT Hóa học 11: a) Tính pH của dung dịch có nồng độ ion H+ là 4,2×10-10 M
Bài 2.20 trang 13 SBT Hóa học 11: Để chuẩn độ 50 mL dung dịch CH3COOH chưa biết nồng độ.,..
Bài 2.21 trang 13 SBT Hóa học 11: Trong phương pháp chuẩn độ acid – base, xung quanh điểm tương...
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.