Toptailieu.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 1: Sự điện li chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Hóa học lớp 11
Giải bài tập Hóa học lớp 11 Bài 1: Sự điện li
Bài tập trang 7 SGK Hóa học 11
Bài 1 trang 7 sgk Hóa học 11 Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì ?
Lời giải:
Các dung dịch HCl, NaOH, NaCl dẫn điện được vì khi hòa tan trong nước thì các chất này phân li ra các ion âm và ion dương chuyển động tự do trong dung dịch
Thí dụ:
HCl → H+ + Cl-
NaOH → Na+ + OH-
NaCl → Na+ + Cl-
Các dung dịch ancol etylic, saccarozơ, glixerol không dẫn điện được vì khi hòa tan trong nước không phân li ra ion âm và ion dương.
Bài 2 trang 7 sgk Hóa học 11 Sự điện li, chất điện li là gì ?
Những loại chất nào là chất điện li ? Thế nào là chất điện li mạnh, chất điện li yếu ?
Lấy thí dụ và viết phương trình điện li của chúng.
Lời giải:
- Quá trình phân li các chất trong nước ra ion gọi là sự điện li.
- Những chất tan trong nước phân li ra ion gọi là những chất điện li.
- Axit, bazơ, muối là những chất điện li.
- Chất điện li mạnh là các chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Ví dụ: NH4Cl -> NH4+ + Cl–
- Chất điện li yếu là chất khi tan trong nước, các phân tử hòa tan chỉ phân li một phần ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.phương trình điện li của những chất sau:
Bài 3 trang 7 sgk Hóa học 11 Viết phương trình điện li của những chất sau:
a) Các chất điện li mạnh: Ba(NO3)2 0,10M; HNO3 0,020M ; KOH 0,010M.
Tính nồng độ mol của từng ion trong các dung dịch trên.
b) Các chất điện li yếu: HClO, HNO2.
Phương pháp giải:
- Những chất điện li mạnh khi tan trong nước phân li hoàn toàn ra các ion.
- Những chất điện li yếu là những chất khi tan trong nước chỉ phân li một phần ra ion.
Lời giải:
a) Các chất điện li mạnh phân li hoàn toàn nên phương trình điện li và nồng độ các ion trong dung dịch như sau:
Ba(NO3)2 → Ba2+ + 2NO-3
0,10M 0,10M 0,20M
HNO3 → H+ + NO-3
0,020M 0,020M 0,020M
KOH → K+ + OH-
0,010M 0,010M 0,010M
b) Các chất điện li yếu phân li không hoàn toàn nên phương trình điện li như sau:
HClO ⇌ H+ + ClO-
HNO2 ⇌ H+ + NO-2
Bài 4 trang 7 sgk Hóa học 11 Chọn câu trả lời đúng trong các câu sau đây:
Dung dịch chất điện li dẫn điện được là do
A. sự chuyển dịch của các electron.
B. sự chuyển dịch của các cation.
C. sự chuyển dịch của các phân tử hòa tan.
D. sự chuyển dịch của cả cation và anion.
Lời giải:
Dung dịch chất điện li dẫn điện được do sự chuyển dịch của cả cation và anion.
Đáp án D.
Bài 5 trang 7 sgk Hóa học 11 Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước.
Lời giải:
KCl rắn tồn tại dưới dạng tinh thể ion. Mạng tinh thể KCl tương tự mạng tinh thể NaCl (hình 3.1 SGK lớp 10). Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các ion K+ và Cl- chỉ dao động tại các đầu nút của mạng tinh thể (không chuyển dịch tự do) vì vậy, KCl rắn, khan không dẫn điện.
Đáp án A
Lý thuyết Bài 1: Sự điện li
Sự điện li là quá trình phân li các chất trong nước hoặc khi nóng chảy thành ion
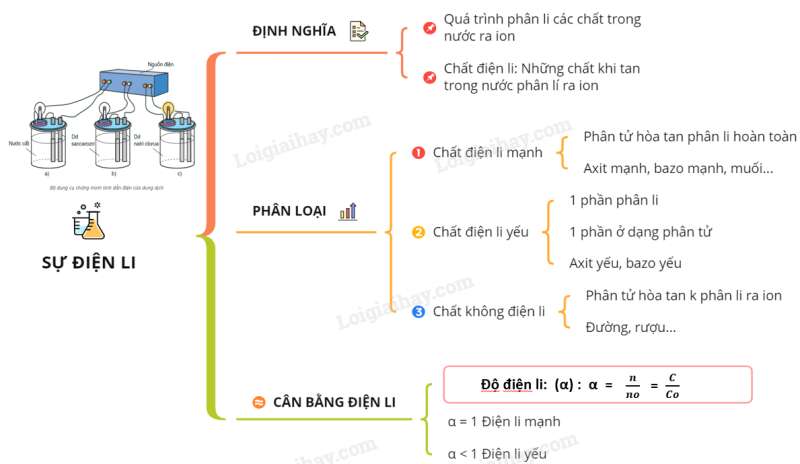
I. ĐỊNH NGHĨA
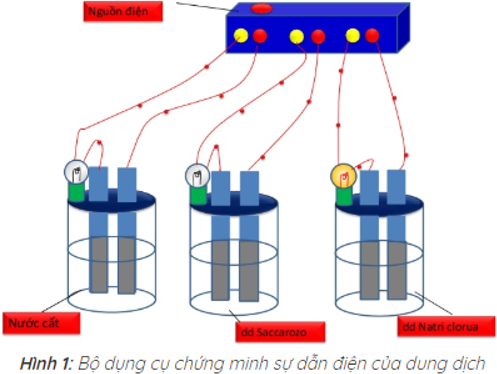
=> Kết quả thí nghiệm cho thấy chỉ có bóng đèn ở cốc đựng dung dịch NaCl sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozo không dẫn điện.
- Sự điện li là quá trình phân li các chất trong nước hoặc khi nóng chảy thành ion.
- Dung dịch (dd) dẫn điện được là do trong dung dịch của chúng có các hạt mang điện tích chuyển động tự do được gọi là các ion.
- Chất điện li là những chất khi tan trong nước phân li ra ion.
- Axit, bazơ, muối đều là những chất điện li.
II. PHÂN LOẠI
1.Chất điện li mạnh
- Là chất khi tan trong nước, các phân tử hòa tan phân li hoàn toàn.
VD:
Na2SO4 → 2Na+ + SO42-
KOH → K+ + OH-
HNO3 → H+ + NO3–
- Các axit mạnh, bazơ mạnh và hầu hết các muối là chất điện li mạnh.
2. Chất điện li yếu
- Là chất khi tan trong nước, số phân tử hòa tan phân li một phần, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Các axit yếu, bazơ yếu và một số muối là chất điện li yếu.
VD: CH3COOH ↔ CH3COO- + H+
3. Chất không điện li
- Là những chất khi tan trong nước không phân li ra ion.
VD: Dung dịch đường, dung dịch rượu, ...
III. CÂN BẰNG ĐIỆN LI
- Sự phân li của các chất điện li yếu là quá trình thuận nghịch. Khi tốc độ phân li của phân tử chất điện li (phản ứng thuận) bằng tốc độ kết hợp giữa các ion thành phân tử chất điện li (phản ứng nghịch) thì cân bằng của quá trình điện li được thiết lập.
Độ điện li: (α) α = =
Với : n là số phân tử phân li ra ion, nolà số phân tử hòa tan.
C là nồng độ mol chất tan phân li thành ion, Co là nồng độ mol chất hòa tan.
Sơ đồ tư duy: Sự điện li.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.