Toptailieu.vn xin giới thiệu 15 câu trắc nghiệm Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm Cánh diều (có đáp án 2023) CHỌN LỌC, hay nhất giúp học sinh lớp 10 ôn luyện kiến thức để đạt kết quả cao trong các bài thi môn Hóa học.
Mời các bạn đón xem:
15 câu trắc nghiệm Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm Cánh diều (có đáp án 2023) CHỌN LỌC
Lý thuyết
I. Xu hướng biến đổi bán kính nguyên tử
1. Trong một chu kì
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyen tử có xu hướng giảm dần.
- Giải thích: Trong cùng một chu kì có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính nguyên tử giảm
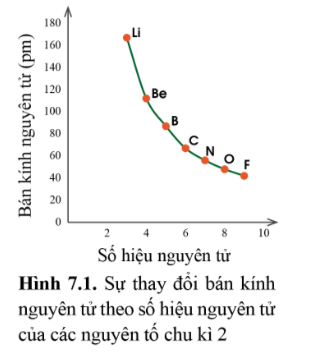
2. Trong một nhóm A
Quy luật: Trong một nhóm, theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần.
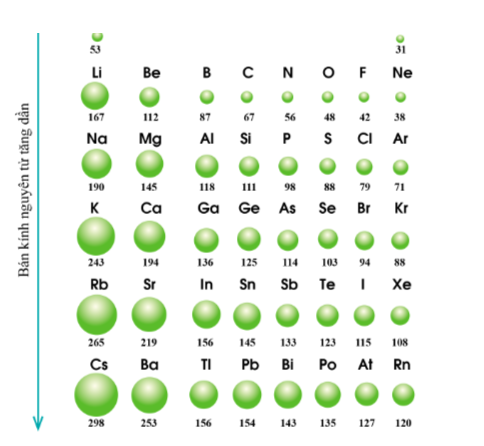
- Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, số lớp electron tăng dần => bán kính nguyên tử tăng dần
II. Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
1. Độ âm điện
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử.
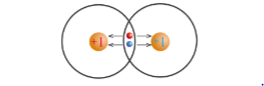
Cặp electron liên kết bị các nguyên tử hút về phía hạt nhân của mỗi nguyên tử H

* Quy luật chung đối với các nguyên tố nhóm A:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
- Trong một nhóm, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.
* Giải thích:
- Trong một chu kì, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần nên khả năng hút cặp electron liên kết càng tăng => độ âm điện tăng.
- Trong một nhóm, từ trên xuống dưới theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng lên => lực hút cua hạt nhân tới cặp electron liên kết giảm => độ âm điện giảm
2. Tính kim loại và tính phi kim
Tính kim loại đặc trưng nởi khả năng nhường electron của nguyên tử, tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử.
* Quy luật chung đối với các nguyên tố nhóm A:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần.
- Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
* Giải thích:
- Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần => lực hút của hạt nhân tới electron hóa trị tăng, làm giảm khả năng nhường electron => tính kim loại giảm.
- Trong cùng một nhóm A, bán kính nguyên tố tăng nhanh => lực hút của hạt nhân tới electron hóa trị giảm dần => làm tăng khả năng nhường electron => tính kim loại tăng.
III. Xu hướng biến đổi thành phần và tính acid, tính base của các oxide và các hydroxide theo chu kì
1. Thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
Oxide cao nhất của một nguyên tố là oxide mà trong đó, hóa trị của nguyên tố đó là cao nhất.
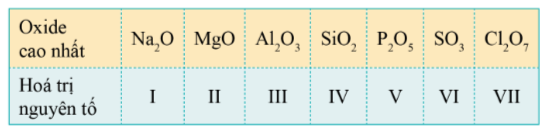
Công thức oxide cao nhất của các nguyên tố nhóm A chu kì 3
* Xu hướng biến đổi thành phần của các oxide cao nhất:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, tỉ số giữa số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất có xu hướng tăng dần.
* Xu hướng biến đổi tính acid, tính base của oxide cao nhất:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
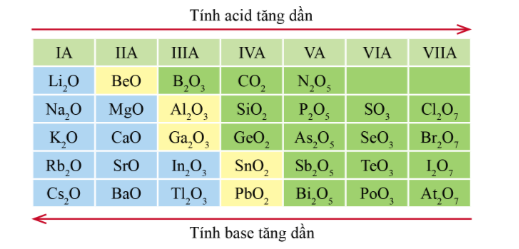
Xu hướng biến đổi tính acid tính base của một số oxide cao nhất
2. Thành phần và tính acid, tính base của các hydroxide trong một chu kì
Xu hướng: Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.

Bài tập
Câu 1. Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử có xu hướng
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. tăng sau đó giảm dần.
Đáp án: B
Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử có xu hướng giảm dần.
Câu 2. Bán kính nguyên tử của nguyên tố nào sau đây nhỏ nhất trong bảng tuần hoàn?
A. H.
B. C.
C. He.
D. Be.
Đáp án: C
Quy luật chung đối với các nguyên tố nhóm A:
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử có xu hướng giảm dần.
→ Bán kính nguyên tử chu kì 1: H > He.
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần.
→ Bán kính nguyên tử nhóm VIIIA: He < Ne < Ar < ….
Vậy: He là nguyên tử nguyên tố có bán kính nhỏ nhất trong bảng tuần hoàn.
Câu 3. Độ âm điện (χ) là đại lượng đặc trưng cho
A. khả năng nhường electron liên kết của một nguyên tử trong phân tử.
B. khả năng hút electron liên kết của một nguyên tử trong phân tử.
C. số nguyên tử của một nguyên tố trong phân tử.
D. khối lượng của nguyên tố trong phân tử.
Đáp án: B
Độ âm điện (χ) là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử.
Câu 4. Độ âm điện của H và N lần lượt là 2,2 và 3,0. Trong phân tử NH3, cặp electron liên kết
A. sẽ bị lệch về phía nguyên tử H.
B. không bị lệch về phía nguyên tử nào.
C. sẽ bị lệch về phía nguyên tử N.
D. ban đầu bị lệch về phía nguyên tử N, sau đó bị lệch về phía nguyên tử H.
Đáp án: C
Độ âm điện của H và N lần lượt là 2,2 và 3,0.
→ Nguyên tử N hút electron liên kết mạnh hơn nguyên tử H, gấp 3,0 : 2,2 ≈ 1,36 lần.
Vậy trong phân tử NH3, cặp electron liên kết sẽ bị lệch về phía nguyên tử N.
Câu 5. Trong phân tử Cl2, cặp electron liên kết có bị lệch về phía nguyên tử nào không?
A. Không bị lệch về nguyên tử nào.
B. Bị lệch về phía một nguyên tử Cl.
C. Không xác định được.
D. Không có cặp electron liên kết.
Đáp án: A
Trong phân tử Cl2, hai nguyên tử Cl đều có độ âm điện giống nhau nên khả năng hút electron liên kết như nhau.
→ Cặp electron liên kết của phân tử Cl2 không bị lệch về nguyên tử nào.
Câu 6. Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. giảm sau đó tăng dần.
Đáp án: B
Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.
Câu 7. Cho các nguyên tố: X (Z = 11); Y (Z = 13); T (Z = 17). Độ âm điện của nguyên tử các nguyên tố tăng dần theo thứ tự là:
A. T < Y < Z.
B. X < T < Y.
C. T < X < Y.
D. X < Y < T.
Đáp án: D
Cấu hình electron của nguyên tử các nguyên tố:
X (Z = 11): 1s22s22p63s1 → X nằm ở ô số 11, chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 → Y nằm ở ô số 13, chu kì 3, nhóm IIIA.
T (Z = 17): 1s22s22p63s23p5 → T nằm ở ô số 17, chu kì 3, nhóm VIIA.
→ X, Y, T đều thuộc chu kì 3.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
→ So sánh độ âm điện: X < Y < T.
Câu 8. Phát biểu nào sau đây không đúng?
A. Trong một nhóm A, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
B. Tính kim loại và tính phi kim luôn biến đổi ngược chiều nhau.
C. Độ âm điện và tính phi kim của các nguyên tử nguyên tố hóa học biến đổi ngược chiều trong một chu kì và một nhóm.
D. Cs là kim loại mạnh nhất, F là phi kim mạnh nhất.
Đáp án: C
Độ âm điện và tính phi kim của các nguyên tử nguyên tố hóa học biến đổi cùng chiều trong một chu kì và một nhóm.
Câu 9. Nguyên tố Cl ở nhóm VIIA, oxide cao nhất của nguyên tố Cl là
A. Cl2O3.
B. Cl2O4.
C. Cl2O.
D. Cl2O7.
Đáp án: D
Nguyên tố Cl ở nhóm VIIA → Hóa trị cao nhất của Cl là VII.
→ Oxide cao nhất của nguyên tố Cl là Cl2O7.
Câu 10. Oxide nào sau đây vừa có tính acid, vừa có tính base?
A. Na2O.
B. Cl2O7.
C. Al2O3.
D. MgO.
Đáp án: C
Oxide Al2O3 vừa có tính acid, vừa có tính base (tính lưỡng tính).
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Câu 11. Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, xu hướng biến đổi tính acid, tính base của hydroxide nào sau đây là đúng?
A. Tính acid có xu hướng tăng dần, tính base có xu hướng giảm dần.
B. Tính acid có xu hướng giảm dần, tính base có xu hướng tăng dần.
C. Tính acid và tính base đều có xu hướng tăng dần.
D. Tính acid và tính base đều có xu hướng giảm dần.
Đáp án: A
Xu hướng biến đổi tính acid, tính base của hydroxide:
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid có xu hướng tăng dần, tính base có xu hướng giảm dần.
Câu 12. Công thức hydroxide của nguyên tố Na (Z = 11) và nguyên tố S (Z = 16) lần lượt là:
A. NaOH; H2SO3.
B. Na(OH)2; H2SO4.
C. NaOH; H2SO4.
D. Na(OH)2, H2SO3.
Đáp án: C
Na (Z = 11): 1s22s22p63s1 → Nguyên tố Na thuộc nhóm IA.
→ Hóa trị cao nhất của Na là I → Công thức hydroxide: NaOH.
S (Z = 16): 1s22s22p63s23p4 → Nguyên tố S thuộc nhóm VIA.
→ Hóa trị cao nhất của S là VI → Công thức hydroxide: H2SO4.
Câu 13. Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 9, 15, 17. Thứ tự tính phi kim tăng dần là:
A. Y, Z, X.
B. X, Z, Y.
C. Z, X, Y.
D. Y, X, Z.
Đáp án: A
Cấu hình electron nguyên tử:
X (Z = 9): 1s22s22p5 → X thuộc chu kì 2, nhóm VIIA.
Y (Z = 15): 1s22s22p63s23p3 → Y thuộc chu kì 3, nhóm VA.
Z (Z = 17): 1s22s22p63s23p5 → Z thuộc chu kì 3, nhóm VIIA.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng tăng dần.
→ Tính phi kim: Y < Z (Y, Z cùng thuộc chu kì 3).
Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng giảm dần.
→ Tính phi kim: X > Z (X, Z cùng thuộc nhóm VIIA).
Vậy: Tính phi kim tăng dần là Y < Z < X.
Câu 14. Cho các đặc trưng sau:
(1) Dễ nhường electron
(2) Dễ nhận electron
(3) Oxide cao nhất có tính base
(4) Oxide cao nhất có tính acid
Những đặc trưng thuộc về kim loại nhóm A là
A. (1); (4).
B. (1); (3).
C. (2); (4).
D. (2); (3).
Đáp án: B
Những đặc trưng thuộc về kim loại nhóm A là:
(1) Dễ nhường electron
(3) Oxide cao nhất có tính base
Câu 15. Cho các nguyên tố A, B, C, D có số hiệu nguyên tử lần lượt là 11, 12, 13, 14. Trong các nguyên tố trên, nguyên tố có tính kim loại mạnh nhất là
A. nguyên tố A.
B. nguyên tố B.
C. nguyên tố C.
D. nguyên tố D.
Đáp án: A
Cấu hình electron nguyên tử:
A (Z = 11): 1s22s22p63s1 → A thuộc chu kì 3, nhóm IA.
B (Z = 12): 1s22s22p63s2 → B thuộc chu kì 3, nhóm IIA.
C (Z = 13): 1s22s22p63s23p1 → C thuộc chu kì 3, nhóm IIIA.
D (Z = 14): 1s22s22p63s23p2 → D thuộc chu kì 3, nhóm IVA.
→ Các nguyên tố A, B, C, D cùng thuộc chu kì 3.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố nhóm A có xu hướng giảm dần.
→ So sánh tính kim loại: A > B > C > D.
Xem thêm các bài giải Trắc nghiệm Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.