Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 5) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 5)
Câu 1: Nêu hiện tượng và viết phương trình phản ứng xảy ra khi cho Na vào dung dịch MgCl2?
Lời giải:
Hiện tượng: Ban đầu có khí thoát ra, tiếp theo có kết tủa trắng.
1) 2Na + 2H2O → 2NaOH + H2↑
2) 2NaOH + MgCl2 → 2NaCl + Mg(OH)2↓
Câu 2: Kẽm (Zn) tác dụng với dung dịch đồng(II) sunfat (CuSO4)
- Hiện tượng:……….
- Nhận xét:………….
- Phương trình hoá học:………….
Lời giải
- Hiện tượng: Kẽm tan dần, dung dịch màu xanh lam của dung dịch nhạt dần, có chất rắn màu đỏ bám bên ngoài kẽm.
- Nhận xét: Kẽm đã đẩy đồng ra khỏi dung dịch đồng (II) sunfat nên kẽm hoạt động hóa học mạnh hơn đồng.
- PTHH: Zn + CuSO4 → ZnSO4 + Cu↓
Lời giải
Khi làm bánh người ta thường cho bột nở (baking soda, NaHCO3) vào để bánh phồng to và xốp hơn vì khi làm bánh, bột NaHCO3 sẽ bị nhiệt phân tạo ra khí CO2 thoát ra từ trong bánh, giúp bánh phồng lên và tơi xốp hơn khi không có bột nở.
PTHH:
Lời giải
Công thức cấu tạo H2S là:
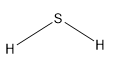
Lời giải
Fe thụ động trong HNO3 đặc, nguội, chỉ có Cu phản ứng theo PTHH:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
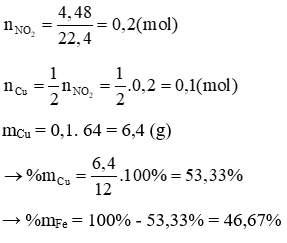
a) Viết các phương trình hóa học
b) Tính nồng độ mol của dung dịch HCl đã dùng
c) Tính thành phần % của các kim loại trong 12,1 gam hỗn hợp ban đầu.
Lời giải
a) Các phương trình hoá học xảy ra:
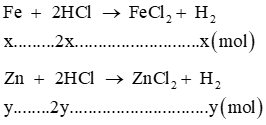

Câu 7: Nhận biết các dung dịch không nhãn sau: KCl, NH4NO3, KNO3, K3PO4?
Lời giải:
- Trích các mẫu thử.
- Dùng dung dịch KOH để nhận biết 4 dung dịch:
+ Mẫu thử nào có khí mùi khai thoát ra là NH4NO3
PTHH: NH4NO3 + KOH → KNO3 + NH3↑ + H2O
+ Các mẫu thử còn lại không có hiện tượng gì (nhóm I).
- Dùng dung dịch AgNO3 cho vào 3 mẫu thử nhóm I:
+ Mẫu thử nào cho kết tủa màu trắng thì là KCl
KCl + AgNO3 → KNO3 + AgCl (↓ trắng)
+ Mẫu thử xuất hiện kết tủa vàng: K3PO4
K3PO4 + 3AgNO3 → Ag3PO4 (↓ vàng) + 3KNO3
+ Mẫu thử còn lại không có hiện tượng gì là KNO3.
Lời giải
Ta có:
Lời giải
a. Cường độ dòng điện qua bình điện phân:
b. Lượng bạc bám vào cực âm sau 2h là:
1. Tính khối lượng khí O2 đã tham gia phản ứng?
2. Hợp chất A chứa những nguyên tố hóa học nào?
3. Xác định công thức hóa học của A, biết tỉ khối hơi của A so với khí O2 bằng 1,4375 lần?
4. Tính số phân tử có trong 18,4 gam A?
Lời giải:
1.
Bảo toàn khối lượng:
2.
Bảo toàn C:
Bảo toàn H:
Vậy A chứa C, H, O.
3. nC : nH : nO = 0,8 : 2,4 : 0,4 = 2 : 6 : 1
→ CTN: (C2H6O)n
Mà MA = 1,4375. 32 = 46 g/mol
→ (12. 2 + 6 + 16). n = 46 → n = 1
Vậy CTHH là C2H6O
4.
→ Số phân tử C2H6O = 0,4. 6,02. 1023 = 2,408.1023 phân tử.
A. 15,68 lít;
B. 1,68 lít;
C. 2,24 lít;
D. 2,88 lít.
Lời giải:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O
Ta có:
→ 0,2 < nHCl = 2.nhh < 0,24
→ Hỗn hợp CaCO3 và MgCO3 dư, HCl phản ứng hết
Lời giải
- Các electron gần hạt nhân nhất thì liên kết với nhân chặt chẽ nhất, trạng thái bền nhất, khó tách khỏi nguyên tử nhất nên có mức năng lượng thấp nhất.
- Những electron xa hạt nhân hơn dễ tách khỏi nguyên tử, chúng có mức năng lượng cao hơn và electron xa hạt nhân nhất có mức năng lượng cao nhất, dễ tách khỏi nguyên tử nhất. Chính những electron này quy định tính chất hoá học của nguyên tố.
A. 18,1 gam;
B. 15 gam;
C. 8,4 gam;
D. 20 gam.
Lời giải
Đáp án đúng là: B
Ta có:
Sau phản ứng thu được các muối CaCO3: x mol và Ca(HCO3)2 y mol.
Bảo toàn C có: x + 2y = 0,2 (1)
Bảo toàn Ca có: x + y = 0,15 (2)
Từ (1) và (2) có x = 0,1 và y = 0,05.
Cô cạn hỗn hợp phản ứng:
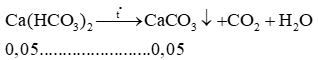
Chất rắn sau phản ứng là CaCO3 có: 0,1 + 0,05 = 0,15 mol
mchất rắn = 0,15.100 = 15 gam.
Câu 14: Cho 150 ml dung dịch Ca(OH)2 2M tác dụng với CO2 thu được muối trung hoà và nước.
a) Tính khối lượng muối?
b) Tính thể tích khí CO2 (đktc)?
Lời giải
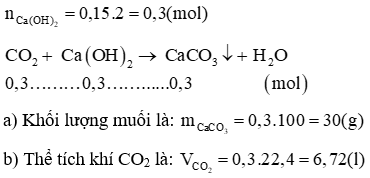
A. N;
B. P;
C. Cl;
D. As.
Lời giải
Đáp án đúng là: A
Nguyên tố có oxit cao nhất là R2O5 → R thuộc nhóm VA
→ Hợp chất với hidro: RH3
Vậy R là nguyên tố nitơ (N)
Câu 16: Hiện tượng nào xảy ra khi trộn dung dịch NH4Cl với dung dịch NaAlO2 và đun nhẹ?
A. Ban đầu có kết tủa keo trắng sau đó tan;
B. Có khí mùi khai bay ra;
C. Không có hiện tượng gì xảy ra;
D. Vừa có kết tủa keo trắng không tan, vừa có khí mùi khai bay ra.
Lời giải
Đáp án đúng là: D
NaAlO2 có tính bazơ, NH4Cl→ có tính axit, tuy nhiên tính axit không đủ mạnh để hòa tan kết tủa Al(OH)3 → hiện tượng thu được là vừa có kết tủa keo trắng không tan, vừa có khí mùi khai bay ra.
PTHH: NH4Cl + NaAlO2 + H2O → NH3↑ + NaCl + Al(OH)3↓
Câu 17: Biết nhóm (SO4) có hóa trị II, trong công thức hoá học Fe2(SO4)3 hóa trị của sắt là?
Lời giải
Gọi x là hoá trị của Fe trong công thức hoá học Fe2(SO4)3
Theo quy tắc hoá trị: x. 2 = II. 3 → x = III
Vậy trong công thức hoá học Fe2(SO4)3 hóa trị của sắt là III.
Câu 18: Trong các hợp chất sau: KF, BaCl2, CH4, H2S các chất nào là hợp chất ion?
A. KF;
B. KF và BaCl2;
C. CH4, H2S;
D. H2S.
Lời giải:
Đáp án đúng là: B
Hợp chất ion là KF và BaCl2
Hợp chất cộng hoá trị là: CH4, H2S.
Câu 19: Cân bằng bằng cách thăng bằng electron:
Al + HNO3 → Al(NO3)3 + NO + H2O
Lời giải
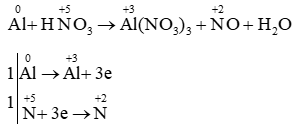
PTHH: Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Câu 20: Cân bằng bằng cách thăng bằng electron:
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Lời giải
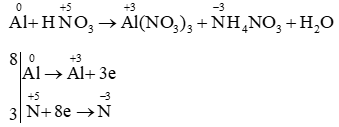
PTHH: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Lời giải:
Quy đổi hỗn hợp X gồm Na (x mol), Ba (y mol), O (z mol)
⇒23x + 137y + 16z = 43,8 (1
Bảo toàn e: x + 2y − 2z = 0,1. 2 (2)
⇒ y = 0,24 (3)
(1) (2) (3) ⇒ x = 0,28; y = 0,24; z = 0,28
⇒ nNaOH = 0,28 (mol)
Ba(OH)2 + CO2 → BaCO3↓ + H2O
Còn lại 0,6 − 0,24 = 0,36 (mol) CO2
⇒ CO2 + NaOH còn dư CO2
NaOH + CO2 → NaHCO3
⇒ còn 0,36 − 0,28 = 0,08 (mol)
BaCO3 + CO2 + H2O → Ba(HCO3)2
tan =0,08 (mol)
⇒ n↓ = 0,24 − 0,08 = 0,16 (mol)
→ = 0,16. 197 = 31,52 gam
Câu 22: Tính số mol của 8 gam Fe2(SO4)3?
Lời giải
Lời giải
Theo đề bài ra, ta có:
Vì sau phản ứng thu được hỗn hợp chất rắn nên CuO còn dư
Gọi nCuO phản ứng = x (mol; x>0)
PTHH:
nCu = nCuO phản ứng = x (mol) → mCu = 64x (g)
nCuO dư = 0,2 – x (mol) → mCuO dư = (0,2 – x). 80 (g)
mhỗn hợp chất rắn = 14,4 (g) → 64x + (0,2 – x). 80 = 14,4 → x = 0,1
mCu = 0,1. 64 = 6,4 (g)
Câu 24: Phản ứng nào sau chứng minh HNO3 có tính axit?
A. 8HNO3 + 6KI → 6KNO3 + 3I2 + 2NO + 4H2O.
B. 4HNO3 + Fe(OH)2 → Fe(NO3)3 + NO2 + 3H2O
C. HNO3 + NH3 →NH4NO3
D. 10HNO3 + 3FeO → 3Fe(NO3)3 + NO + 5H2O.
Lời giải:
Đáp án đúng là: C
+ Phản ứng thuộc đáp án A, B, D thì HNO3 thể hiện tính oxi hóa.
+ Phản ứng thuộc đáp án C thì HNO3 đã nhường proton ⇒ HNO3 thể hiện tính axit
A. 10V;
B. 9V;
C. 3V;
D. 1V.
Lời giải:
Đáp án đúng là: B
Do dung dịch X có pH = 4 nên
Số mol H+ có trong dung dịch có pH = 5 là:
Việc pha loãng dung dịch chỉ làm thay đổi nồng độ mol/l chứ không làm thay đổi số mol H+
Vì vậy:
Vậy cần thêm vào lượng nước có thể tích bằng 9 lần V.
Câu 26: HNO3 tác dụng được với tập hợp tất cả các chất nào trong các dãy sau:
A. BaO, CO2;
B. NaNO3, CuO;
C. Na2O, Na2SO4;
D. Cu, MgO.
Lời giải:
Đáp án đúng là: D
HNO3 không phản ứng với CO2; NaNO3, Na2SO4 → loại A, B, C.
8HNO3 + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O.
2HNO3 + MgO → Mg(NO3)2 + H2O.
Câu 27: Xét phản ứng: R + HNO3 → R(NO3)n + NO + H2O
Hệ số cân bằng của HNO3 là:
A. n;
B. 4n;
C. 3n;
D. 3.
Lời giải:
Đáp án đúng là: B
Quá trình oxi hoá:
Quá trình khử:
Phương trình phản ứng: 3R + 4nHNO3 → 3R(NO3)n + nNO + 2nH2O.
Lời giải:
Mhh = 19,2. 2 = 38,4 g/mol
Gọi x là nNO, y là
Sử dụng sơ đồ đường chéo ta có:
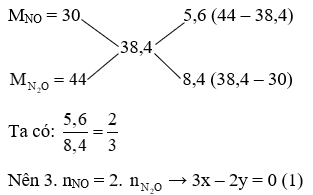
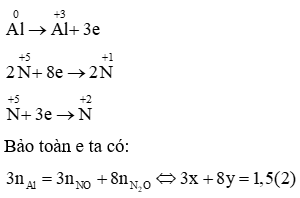
Giải (1), (2), ta được: x = 0,1 (mol); y = 0,15 (mol)
Sử dụng công thức sau:
A. 5,46;
B. 4,65;
C. 6,45;
D. 5,64.
Lời giải:
C6H5NH2 + 3Br2 → Br3C6H2NH2 ↓ + 3HBr
nkết tủa = 16,5 : 330 = 0,05 mol = nanilin
→ manilin = 0,05.93 = 4,65 gam
A. 0,896;
B. 1,792 hoặc 7,168;
C. 1,792;
D. 0,896 hoặc 3,584.
Lời giải:
Đáp án đúng là: B
nNaOH = 0,2 mol;
Vì nên có 2 trường hợp:
- Trường hợp 1: Chưa có sự hoà tan kết tủa
Khí đó: → V= 1,792 (lít)
- Trường hợp 2: Đã có sự hoà tan kết tủa. Khi đó sản phẩm tạo thành gồm muối cacbonat và hidrocabonat
→ V = 7,168 (lít)
Câu 31: Xác định số hạt p, n, e và kí hiệu của nguyên tử X trong các trường hợp sau:
(a) Tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 10;(b) Tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 16;
(c) Tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 28.
Lời giải
(a) Vì tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 10 nên ta có:
p + n + e = 10
Mà p = e nên 2p + n = 10 → n = 10 – 2p (1)
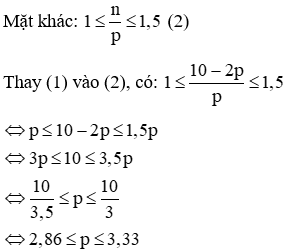
Vậy p = 3 = e, n = 10 – 2. 3 = 4
Nguyên tử X là Liti (kí hiệu: ).
(b) Vì tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 16 nên ta có:
p + n + e = 16
Mà p = e nên 2p + n = 16 → n = 16 – 2p (1)
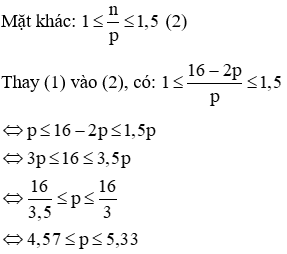
Vậy p = 5 = e, n = 16 – 2. 5 = 6
Nguyên tử X là Bo (Kí hiệu: ).
(c) Vì tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 28 nên ta có:
p + n + e = 28
Mà p = e nên 2p + n = 28 → n = 28 – 2p (1)
Vậy p = 8 hoặc p = 9
Với p = 8 = e, n = 28 – 2. 8 = 12 (Loại vì không có nguyên tử nào thoả mãn).
Với p = 9 = e, n = 28 – 2. 9 = 10 → Nguyên tử X là flo (Kí hiệu: ).
Câu 32: Vật liệu là gì? Vật liệu được phân thành những loại nào?
Lời giải:
Vật liệu là chất hoặc hỗn hợp một số chất được con người sử dụng như nguyên liệu đầu vào trong một quá trình sản xuất hoặc chế tạo để làm ra những sản phẩm phục vụ cuộc sống.
- Ví dụ:
+ Gỗ là vật liệu làm ra bàn, ghế, tủ,...
+ Thủy tinh là vật liệu làm ra cốc, ly, kính ô tô,...
+ Nhựa là vật liệu để làm ra chai, lọ, vỏ bút, vỏ dây điện, xô, chậu, đồ chơi lego,...
- Phân loại:
+ Dựa vào nguồn gốc vật liệu được chia thành: vật liệu tự nhiên (có sẵn trong tự nhiên) như gỗ, đá … và vật liệu nhân tạo (do con người tạo ra) như thủy tinh, nhựa …
+ Dựa vào công dụng vật liệu được chia thành: vật liệu xây dựng, vật liệu cơ khí, vật liệu điện tử, vật liệu sinh học, vật liệu silicate,...
Lời giải:
Trường hợp 1: Phản ứng chỉ tạo muối trung hoà và Ba(OH)2 dư
PTHH: Ba(OH)2 + CO2 → BaCO3↓ + H2O (1)
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O (2)
Theo PTHH (1):
Trường hợp 2: Phản ứng tạo cả 2 muối
Ba(OH)2 + CO2 → BaCO3↓ + H2O (*)
Ba(OH)2 + 2CO2 → Ba(HCO3)2↓ (**)
Ba(HCO3)2 + H2SO4 → BaSO4↓ + 2CO2↑ + 2H2O (***)
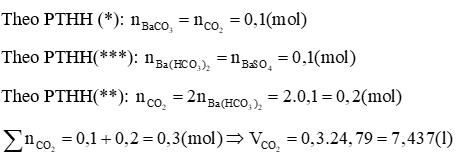
Câu 34: Tương tác giữa electron và một hạt nhân cô lập là:
A. Lực hút;
B. Có thể là lực hút hoặc lực đẩy;
C. Lực đẩy;
D. Bằng không.
Lời giải:
Đáp án đúng là: B
Lời giải:

Câu 36: Oxit nào sau đây tác dụng với CO2 tạo muối cacbonat?
A. BaO;
B. Fe2O3;
C. Al2O3;
D. CuO.
Lời giải:
Đáp án đúng là: A
A. NaAlO2;
B. Na2CO3;
C. NaCl;
D. NaOH.
Lời giải:
Đáp án đúng là: D
- Dùng NaOH từ từ đến dư thì:
+ Với NH4NO3 có khí mùi khai thoát ra
NH4NO3 + NaOH → NH3↑ + NaNO3 + H2O
+ Với Al(NO3)3 có kết tủa sau đó tan khi NaOH dư.
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaCl
NaOH + Al(OH)3 → NaAlO2 + 2H2O
+ Với Fe(NO3)3 có kết tủa màu đỏ nâu xuất hiện
Fe(NO3)3 + 3NaOH → Fe(OH)3↓ + 3NaNO3
+ Với Cu(NO3)2 có kết tủa màu xanh lam xuất hiện
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
+ Với Fe(NO3)2 có kết tủa màu trắng xanh xuất hiện và để kết tủa Fe(OH)2 ngoài không khí hoá nâu đỏ
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
+ Với Mg(NO3)2 có kết tủa màu trắng xuất hiện, kết tủa không tan khi NaOH dư.
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ + 2NaNO3
+ Với NaNO3 không có hiện tượng
a) NaOH + Al(OH)3
b) Al2(SO4)3 + NaOH
c) NaOH + Zn(OH)2
d) FeS + HCl
e) CuSO4 + H2S
f) NaOH + NaHCO3
g) NaHCO3 + HCl
h) Ca(HCO3)2 + HCl
Lời giải
a) NaOH + Al(OH)3 → NaAlO2 + 2H2O
b) Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
c) 2NaOH + Zn(OH)2 → Na2ZnO2 + 2H2O
d) FeS + 2HCl → FeCl2 + H2S↑
e) CuSO4 + H2S → CuS↓ + H2SO
f) NaOH + NaHCO3 → Na2CO3 + H2O
g) NaHCO3 + HCl → NaCl + H2O + CO2↑
h) Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2↑
A. Rb2S;
B. Li2S;
C. Na2S;
D. K2S.
Lời giải
Đáp án đúng là: C
Gọi Z, N, E, Z', N', E' lần lượt là số p, n, e có trong nguyên tử M và X. Hợp chất A được tạo thành từ ion và , do đó A có dạng là M2X.
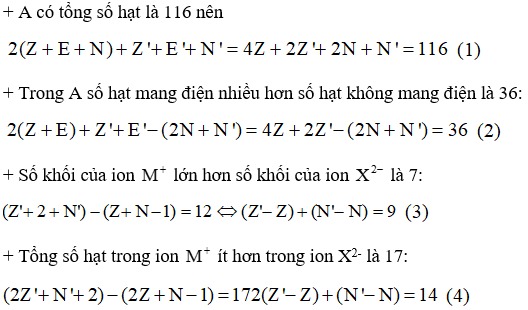
Từ (1), (2), (3), (4) ta có:
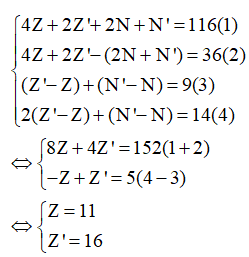
Do đó M là Na và X là S nên A là Na2S.
Lời giải:
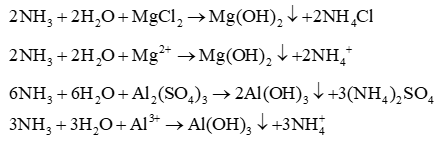
Lời giải:
Gọi V là thể tích dung dịch HCl (l)
→ nHCl = CM. V = 10-pH = 10-2. V = 0,01V (mol)
→ = 0,01V + 2.0,05.0,1 = 0,01V + 0,01 (mol)
pH = 1,2 → [H+] = 10-1,2 = 0,063
→ V = 0,0695 (l) = 6,95 (ml)
Câu 42: Một nguyên tử nguyên tố A có tổng số proton, nơtron, electron là 52. Tìm nguyên tố A.
Lời giải:
Vì tổng số hạt p, n và e trong nguyên tử của nguyên tố X là 52 nên ta có:
p + n + e = 52
Mà p = e nên 2p + n = 52 → n = 52 – 2p (1)
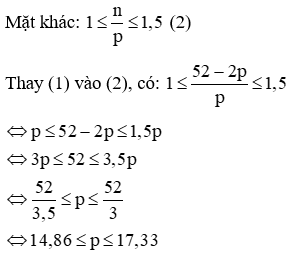
Vậy p = 15 hoặc p = 16 hoặc p = 17
Với p = 15 = e, n = 52 – 2. 15 = 22 (Loại).
Với p = 16 = e, n = 52 – 2. 16 = 20 (Loại).
Với p = 17 = e, n = 52 – 2. 17 = 18 → Nguyên tử A là clo (Cl).
Câu 43: Tìm hóa trị của lưu huỳnh trong các trường hợp sau:
a) SO2
b) SO3
c) H2S
Lời giải:
a) Gọi hóa trị của S trong SO2 là a (a > 0)
Áp dụng quy tắc hóa trị, ta có:
a. 1 = II. 2 → a = IV
Vậy hóa trị của S trong SO2 là IV
b) Gọi hóa trị của S trong SO3 là b (b > 0)
Áp dụng quy tắc hóa trị, ta có:
b. 1 = II. 3 → b = VI
Vậy hóa trị của S trong SO3 là VI
c) Gọi hóa trị của S trong H2S là c (c > 0)
Áp dụng quy tắc hóa trị, ta có:
I. 2 = c. 1 → c = II
Vậy hóa trị của S trong H2S là II.
Câu 44: Nhận biết các chất bằng phương pháp hoá học: KCl, K2CO3, MgSO4, Mg(NO3)2?
Lời giải:
- Trích các mẫu thử.
- Dùng HCl để nhận biết các dung dịch:
+ Dung dịch nào có khí thoát ra là K2CO3 vì
K2CO3 + 2HCl → 2KCl + H2O + CO2↑
+ Các dung dịch còn lại không có hiện tượng gì.
- Dùng AgNO3 để nhận biết tiếp:
+ Dung dịch nào cho kết tủa trắng là KCl hoặc MgSO4 vì:
AgNO3 + KCl → AgCl↓ + KNO3
2AgNO3 + MgSO4 → Ag2SO4↓ + Mg(NO3)2
+ Dung dịch không có hiện tượng gì là: Mg(NO3)2
- Dùng dung dịch BaCl2 để nhận biết 2 dung dịch còn lại:
+ Dung dịch nào xuất hiện kết tủa trắng thì là MgSO4
BaCl2 + MgSO4 → BaSO4↓ + MgCl2
+ Dung dịch không có hiện tượng gì là KCl.
Chú ý: Ag2SO4 là chất ít tan có màu trắng.
A. 24,8;
B. 25,0;
C. 24,4;
D. 24,0.
Lời giải:
Đáp án đúng là: C
Câu 46: Nêu hiện tượng và viết phương trình
a) Hòa tan sắt (II) clorua vào nước rồi thêm axit sunfuric loãng, dư, sau đó thêm dung dịch kali penmanganat.
Lời giải:
a)10FeCl2 + 6KMnO4 + 24 H2SO4 → 5Fe2(SO4)3 + 6MnSO4 + 3K2SO4 + 10Cl2 + 24H20
b) 2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O
Khí X là SO2
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
Câu 47: Nguyên tử R có tổng số hạt là 115 và có số khối là 80. Tìm điện tích hạt nhân của R?
Lời giải:
Theo đề bài ra, ta có:
Z = p = 35.
Điện tích hạt nhân: +Z = +35.
Câu 48: Viết cấu hình electron đầy đủ của các nguyên tố trong các trường hợp sau:
(a) Cấu hình electron lớp ngoài cùng là 3s23p5.
(b) Cấu hình electron lớp ngoài cùng là 4s2.
(c) Có 3 lớp electron, lớp ngoài cùng có 5e.
(d) Tổng số electron trên phân lớp p là 8.
(e) Tổng số electron trên phân lớp s là 6.
Lời giải:
a) 1s22s22p63s23p5;
b) 1s22s22p63s23p64s2;
c) 1s22s22p63s23p3;
d) 1s22s22p63s23p2;
e) Nguyên tố có cấu hình từ: 1s22s22p63s2 đến 1s22s22p63s23p6 đều thoả mãn;
Câu 49: Một cation R3+ có tổng số hạt là 37. Tỉ số hạt e đối với n là 5/7. Tìm số p, e, n trong R3+?
Lời giải:
Vì cation R3+ có tổng số hạt là 37 nên ta có:
p + e + n – 3 = 37 mà p = e nên 2p + n – 3 = 37 → 2p + n = 40 (1)
Tỉ số hạt e đối với n là 5/7 nên (2)
Giải hệ (1), (2) ta được: p = e = 13, n = 14.
Vậy trong R3+ gồm p = 13, e = 10, n = 14.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.