Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 8) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 8)
Câu 1: Thực hiện các thí nghiệm sau:
(a) Cho dung dịch NaHCO3 vào dung dịch BaCl2, đun nóng.
(b) Cho kim loại Na vào dung dịch CuSO4.
(c) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 2 : 1) vào dung dịch HCl dư.
(e) Sục khí CO2 (dư) vào dung dịch NaAlO2.
(f) Cho dung dịch HCl vào dung dịch Na2SiO3 cho đến dư.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được chất kết tủa là:
A. 4;
B. 3;
C. 6;
D. 5.
Lời giải:
Đáp án đúng là: C
(a) 2NaHCO3 + BaCl2 2NaCl + BaCO3↓ + CO2↑ + H2O
⟹ Kết tủa BaCO3.
(b) 2Na + 2H2O → 2NaOH + H2 ↑
2NaOH + CuSO4 → Cu(OH)2 ↓ + Na2SO4
⟹ Kết tủa Cu(OH)2
(c) Ba(OH)2 + Al2(SO4)3 → BaSO4 ↓ + Al(OH)3 ↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
⟹ Kết tủa BaSO4
(d) Fe2O3 + 6HCl → 2FeCl3 + 3H2O
1…………………2 mol
Cu + 2FeCl3 → CuCl2 + 2FeCl2
1 ← 2 mol
⟹ Kết tủa là Cu dư
(e) CO2 + NaAlO2 + 2H2O → NaHCO3 + Al(OH)3↓
⟹ Kết tủa Al(OH)3
(f) 2HCl + Na2SiO3 → 2NaCl + H2SiO3↓
⟹ Kết tủa H2SiO3
Vậy có 6 thí nghiệm thu được kết tủa sau phản ứng.
Câu 2: Viết phương trình ion rút gọn:
a) NaHSO4 + BaCl2
b) NaHSO4 + NaHCO3
c) NaHSO4 + NaOH
d) NaHCO3 + BaCl2
Lời giải:
a) NaHSO4 + BaCl2 → NaCl + BaSO4↓ + HCl
b) NaHSO4 + NaHCO3 → Na2SO4 + CO2 + H2O
c) NaHSO4 + NaOH → Na2SO4 + H2O
d) 2NaHCO3 + BaCl2 2NaCl + BaCO3↓ + CO2 + H2O
Câu 3: Cho sơ đồ phản ứng sau: BaCO3 + HCl → BaCl2 + H2O + CO2
Chọn nhận định đúng, sau khi lập phương trình hóa học:
A. Tỉ lệ phân tử BaCO3 : HCl = 2 : 1;
B. Tỉ lệ phân tử BaCO3 : HCl = 1 : 2;
C. Tỉ lệ phân tử BaCO3 : HCl = 1 : 3;
D. Tỉ lệ phân tử BaCO3 : HCl = 3 : 1.
Lời giải:
Đáp án đúng là: B
Phương trình hoá học khi cân bằng là BaCO3 + 2HCl → BaCl2 + H2O + CO2
Tỉ lệ phân tử BaCO3 : HCl là 1: 2.
- Hoà tan hoàn toàn hỗn hợp vào nước, lọc thu được dung dịch Na2CO3 và hỗn hợp chất rắn gồm BaCO3 và MgCO3. Cho dung dịch Na2CO3 tác dụng với dung dịch HCl dư, sau đó cô cạn dung dịch rồi điện phân nóng chảy thu được Na:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
- Hoà tan hỗn hợp rắn gồm BaCO3 và MgCO3 trong dung dịch HCl dư thu được dung dịch chứa MgCl2, BaCl2 và HCl dư:
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
- Thêm dung dịch Ba(OH)2 dư vào dung dịch sau phản ứng, lọc thu được kết tủa Mg(OH)2:
MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2↓
- Lọc kết tủa hoà tan vào dung dịch HCl, cô cạn dung dịch thu được muối khan MgCl2 rồi điện phân nóng chảy thu được kim loại Mg:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
- Cho dung dịch còn lại sau khi lọc kết tủa Mg(OH)2 tác dụng với HCl dư. Cô cạn ta được muối khan BaCl2 rồi điện phân nóng chảy thu được Ba:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
A. 4,38;
B. 2,22;
C. 1,78;
D. 2,18.
Lời giải
Đáp án đúng là: B
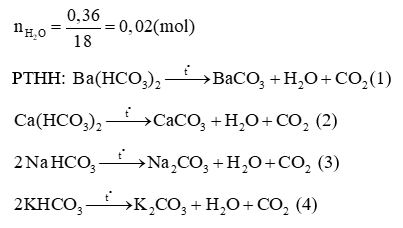
Theo các PTHH:
Áp dụng định luật bảo toàn khối lượng cho các PTHH, ta có:
mhỗn hợp ban đầu = mmuối thu được +
→ mmuối thu được = mhỗn hợp ban đầu – ( ) = 3,46 – 0,88 – 0,36 = 2,22 (g)
Vậy giá trị của m là 2,22.
Câu 6: Ba(HCO3)2 có kết tủa không?
Lời giải:
Ba(HCO3)2 không kết tủa nhưng nếu đem Ba(HCO3)2 nung thì có kết tủa trắng của BaCO3 theo phương trình:
Câu 7: Dãy gồm các muối đều tan trong nước là:
A. CaCO3, MgCO3, Mg(HCO3)2, K2CO3;
B. CaCO3, NaHCO3, Mg(HCO3)2, Na2CO3;
C. CaCO3, Na2CO3, NaHCO3, MgCO3;
D. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Lời giải:
Đáp án đúng là: D
Dãy gồm các muối đều tan trong nước là: Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Lời giải:
Gọi số proton và nơtron trong nguyên tử Y lần lượt là P, N
Nguyên tử Y có tổng số electron, proton, nơtron là 46, số proton = số electron nên:
2P + N = 46 → N = 46 – 2P (1)
Mà
Thay (1) vào (2), ta có:
→ P = 14 hoặc P = 15
Nếu P = 14 → N = 46 – 2.14 = 18
→ P + N = 14 + 18 = 32 (Loại vì nguyên tử khối của Y bé hơn 32 đvC)
Suy ra P = 15 → N = 46 – 2.15 = 16
→ P + N = 15 + 16 = 31 (Nhận)
Vậy Y là photpho (P).
Câu 9: Cho sơ đồ các phản ứng sau.
a, Na + O2 → Na2O
b, P2O5 + H2O → H3PO4
c, HgO → Hg + O2
d, Fe(OH)3 → Fe2O3 + H2O
e, Na2CO3 + CaCl2 → CaCO3 + NaCl
Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng?
Lời giải:
a, 4Na + O2 2Na2O
Số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 4 : 1 : 2
b, P2O5 + 3H2O → 2H3PO4
Số phân tử P2O5 : số phân tử H2O : số phân tử H3PO4 = 1 : 3 : 2
c, 2HgO 2Hg + O2
Số phân tử HgO : số nguyên tử Hg : số phân tử O2 = 2 : 2 : 1
d, 2Fe(OH)3 Fe2O3 + 3H2O
Số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3
e, Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Số phân tử Na2CO3 : số phân tử CaCl2 : số phân tử CaCO3 : số phân tử NaCl = 1 : 1 : 1 : 2.
A. 0,05;
B. 0,07;
C. 0,1;
D. 0,08.
Lời giải:
Đáp án đúng là: B
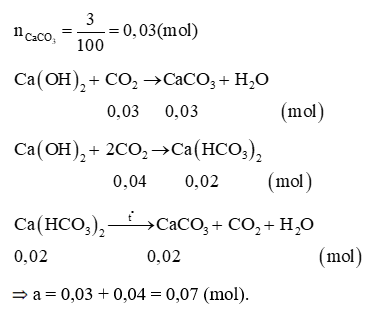
Lời giải:
Các công thức viết sai là: Al(NO3)2, HCl2, Ca2Cl, Na2O3.
Sửa:
Al(NO3)2: Vì Al hoá trị III, NO3 hoá trị I → Al(NO3)3
HCl2: Vì H hoá trị I, Cl hoá trị I → HCl
Ca2Cl: Vì Ca hoá trị II, Cl hoá trị I → CaCl2
Na2O3: Vì Na hoá trị I, O hoá trị II → Na2O
Câu 12: 1. Base không tan + Acid → ….. + …..
2. Base không tan bị nhiệt phân huỷ
Base không tan ….. + …..
Lời giải:
1. Base không tan + Acid → Muối + H2O
→ VD: Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
2. Base không tan Basic oxide + H2O
→ VD: Cu(OH)2 CuO + H2O
Câu 13: Benzen có làm đổi màu quỳ tím không?
Benzen không làm đổi màu quỳ tím.
A. 11 u;
B. 22,98 u;
C. 12 u;
D. 23 u.
Lời giải:
Câu 15: Biết S có hoá trị II, hoá trị của magie trong hợp chất MgS là?
Lời giải:
Đáp án đúng là: B
Gọi hoá trị của Mg trong hợp chất MgS là x (x > 0)
Áp dụng quy tắc hoá trị, ta có:
x. 1 = II. 1 → x = II
Vậy hoá trị của Mg trong hợp chất MgS là II.
Câu 16: Bo trong tự nhiên có hai đồng vị bền: và . Nguyên tử khối trung bình của Bo là 10,81.
Lời giải:
a) Gọi a, b lần lượt là phần trăm của 2 đồng vị và
Khối lượng trung bình của Bo là 10,81
b = 100% - 19% = 81%
b) Nếu có 760 nguyên tử thì số nguyên tử đồng vị là:
A. 49,3%;
B. 50,7%;
C. 46%;
D. 54%.
Lời giải:
Đáp án đúng là: B
Gọi phần trăm số nguyên tử của và lần lượt là x% và y%
Ta có hệ phương trình:
Vậy nếu nguyên tử khối mỗi đồng vị có giá trị bằng số khối thì tỉ lệ % số nguyên tử đồng vị là: 50,7%.
A. 87,02%;
B. 26,45%;
C. 22,08%;
D. 28,02%.
Lời giải:
Đáp án đúng là: C
Gọi % số nguyên tử của mỗi đồng vị 79Br và 81Br là x% và y%. Ta có:
Giả sử có 1 mol KBrO3, số mol 81Br =
Câu 19: Viết công thức cấu tạo các ankin có tên gọi sau đây:
a) Axetilen.
b) But – 2 – in.
c) But – 1 – in.
d) Propin.
Lời giải:
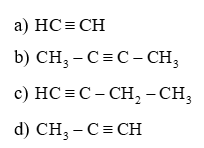
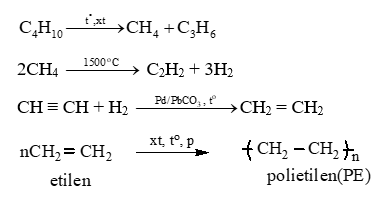
Câu 20: Hoàn thành sơ đồ phản ứng sau:
Butan → metan → axetilen → etilen → polietilen (nhựa P.E)
Lời giải:
Câu 21: Viết phương trình hóa học thực hiện chuỗi chuyển hóa sau (ghi rõ điều kiện nếu có):
C → CO → CO2 → NaHCO3 → Na2CO3 → NaCl → Cl2 → FeCl3 → Fe
Lời giải:
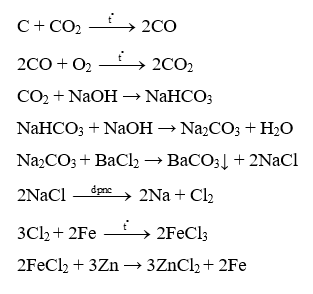
Câu 22: Hoàn thành các chuỗi phản ứng sau:
Lời giải:
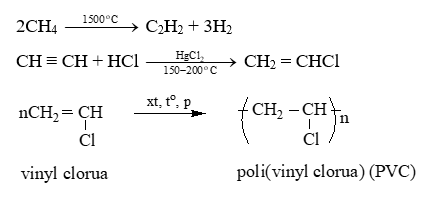
Câu 23: Cho biết loại liên kết trong các phân tử MgCl2, CO2, C2H4?
Lời giải:
- Hiệu độ âm điện của Mg và Cl là: 3,16 - 1,31 = 1,85 nên liên kết trong phân tử MgCl2 là liên kết ion.
- Hiệu độ âm điện của C và O là: 3,44 - 2,55 = 0,89 nên liên kết trong phân tử CO2 là liên kết cộng hóa trị phân cực.
- Hiệu độ âm điện của C và H là: 2,55 - 2,2 = 0,35 nên liên kết trong phân từ C2H4 là liên kết cộng hóa trị không phân cực.
Câu 24: Giữa C2H4 và C2H2 thì hidrocacbon nào làm mất màu dung dịch nước brom nhanh hơn?
Lời giải:
Cùng một lượng brom, ankin sẽ làm mất màu dung dịch brom nhanh hơn anken.
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2.
Câu 25: Phương trình từ C2H4 ra nhựa PE?
Lời giải:
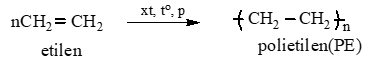
Câu 26: Số đồng phân chứa dẫn xuất brom C3H6Br2 và C3H7Br?
Lời giải:
Số đồng phân chứa dẫn xuất brom C3H6Br2 là 3 đồng phân:
CH3 – CH2– CHBr2
CH3 – CBr2 – CH3
CH3 – CHBr – CH2Br
CH2Br – CH – CH2Br
Số đồng phân chứa dẫn xuất brom C3H7Br là 2 đồng phân:
CH3 – CH2 – CH2Br
CH3 – CHBr – CH3
Câu 27: Chất C4H6O2 có bao nhiêu đồng phân là axit mạch hở?
A. 2;
B. 5;
C. 4;
D. 3.
C4H6O2 có trong đó 1 ở nhóm chức – COOH, còn 1 ở trong gốc hiđrocacbon.
Chất C4H6O2 có số đồng phân là axit mạch hở là:
1. CH2 = CH – CH2 - COOH
2. CH3 – CH = CH – COOH
3. CH2 = C(CH3) - COOH
HOCH2[CHOH]4CHO + 2AgNO3 + 3NH3 + H2O HOCH2[CHOH]4COONH4 + 2Ag↓ + 2NH4NO3
Lời giải:
Ca3(PO4)2 có kết tủa. Nó sẽ xuất hiện kết tủa trắng Ca3(PO4)2 trong dung dịch.
Câu 30: Cân bằng phương trình bằng phương pháp thăng bằng e:
Lời giải:
a)
Câu 31: Cân bằng phương trình phản ứng sau bằng phương pháp thăng bằng electron:
Mg + HNO3 → Mg(NO3)2 + NO + H2O
Tổng các hệ số trong phuơng trình hoá học là:
A. 24;
B. 26;
C. 13;
D. 20.
Lời giải:
Đáp án đúng là: D
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Câu 32: Cân bằng phương trình bằng phương pháp thăng bằng electron:
Mg + HNO3 → Mg(NO3)2 + NO + NO2 + H2O
Lời giải:
2Mg + 6HNO3 → 2Mg(NO3)2 + NO + NO2 + 3H2O
Lời giải:
3 Zn: Ba nguyên tử kẽm (zinc)
2 Fe: Hai nguyên tử sắt (iron)
4 Ag: Bốn nguyên tử bạc (silver)
5 K: Năm nguyên tử kali (potassium)
6 Ca: Sáu nguyên tử canxi (calcium)
3 N: Ba nguyên tử nitơ (nitrogen)
2 S: Hai nguyên tử lưu huỳnh (sulfur)
9 Pb: Chín nguyên tử chì (lead)
8 Cl: Tám nguyên tử clo (chlorine)
7 Mg: Bảy nguyên tử magie (magnessium).
Câu 34: Chỉ dùng một hoá chất tuỳ ý, hãy nhận biết chất sau: Mg, K, BaCl2, MgCl2.
Lời giải
Trích các mẫu thử
Hoà tan mẫu các chất cần nhận biết vào nước ở nhiệt độ thường:
- Chất rắn nào tan và tạo khí là K
2K + 2H2O → 2KOH + H2↑
- Chất rắn nào tan trong nước là BaCl2 hoặc MgCl2.
- Chất rắn nào không tan trong nước là Mg
Cho KOH vừa thu được vào nhóm tan trong nước
- Dung dịch nào xuất hiện kết tủa là MgCl2
MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl
- Dung dịch còn lại không có hiện tượng gì là BaCl2.
Lời giải:
Quá trình sản xuất axit sunfuric từ lưu huỳnh gồm 3 công đoạn:
- Sản xuất SO2 bằng cách đốt S (hoặc quặng pirit) trong không khí:
4FeS2 + 11O2 2Fe2O3 + 8SO2
- Sản xuất SO3 từ SO2:
- Sản xuất H2SO4 từ SO3: SO3 + H2O → H2SO4.
A. Dùng H2O và dung dịch HCl;
B. Dùng dung dịch NaOH và dung dịch HCl;
C. Dùng dung dịch HCl và dung dịch AgNO3;
D. Dùng dung dịch NaOH và dung dịch AgNO3.
Lời giải:
Đáp án đúng là: B
|
Thuốc thử |
(Al + Al2O3) |
(Fe + Fe2O3) |
(FeO + Fe2O3) |
|
Dung dịch NaOH |
Khí bay lên |
- |
- |
|
Dung dịch HCl |
- |
Khí bay lên |
- |
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Fe + 2HCl → FeCl2 + H2↑
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeO + 2HCl → FeCl2 + H2O
Câu 37: Cách biểu diễn 4 H2 có nghĩa là:
A. 4 nguyên tử hiđro;
B. 8 nguyên tử hiđro;
C. 4 phân tử hiđro;
D. 8 phân tử hiđro.
Lời giải:
Đáp án đúng là: C
H2 là 1 phân tử hiđro
4 H2 là 4 phân tử hiđro.
Câu 38: Nêu cách nhận biết 4 dung dịch: K2CO3, KOH, KCl, K2SO4.
Lời giải:
Trích các mẫu thử
Cho quỳ tím vào các mẫu thử:
- K2CO3, KOH làm quỳ tím xanh (1)
- KCl, K2SO4 không làm quỳ tím đổi màu (2)
Cho dung dịch BaCl2 vào phần (1) và (2) lần lượt nhận ra:
+ Ở phần (1) K2CO3 tác dụng với BaCl2 tạo kết tủa còn KOH không phản ứng.
+ Ở phần (2) K2SO4 tác dụng với BaCl2 tạo kết tủa còn KCl không phản ứng.
K2CO3 + BaCl2 → BaCO3↓ + 2KCl
K2SO4 + BaCl2 → BaSO4↓ + 2KCl.
Câu 39: Cách nhận biết K2SO4, H2SO4, KOH, KCl?
Lời giải:
- Trích mẫu thử và đánh số thứ tự mỗi mẫu thử.
- Cho quỳ tím vào mỗi mẫu thử nhận ra H2SO4 làm quỳ hóa đỏ; KOH làm quỳ hóa xanh. K2SO4 và KCl không làm đổi màu quỳ tím.
- Cho BaCl2 lần lượt vào hai mẫu không làm đổi màu quỳ tím nhận ra K2SO4 do có xuất hiện kết tủa trắng
BaCl2 + K2SO4 → BaSO4↓ + 2KCl
Câu 40: Cách tính số liên kết xích ma ( )?
Lời giải:
Số liên kết xích ma ( ) = Số nguyên tử - 1.
VD: CH4 (có 5 nguyên tử nên số liên kết xích ma ( ) = 4);
CH2 = CH – CH = CH2 ((C4H6), 10 nguyên tử, số liên kết xích ma ( ) = 9).
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.