Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 13) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 13)
1. KClO3 → KCl + O2
2. Cl2 + NaOH → NaCl + NaClO + H2O
Lời giải:
1.
KClO3 vừa là chất oxi hoá, vừa là chất khử
: quá trình khử
: quá trình oxi hoá
2KClO3 2KCl + 3O2
2.
Cl2 vừa là chất oxi hoá, vừa là chất khử
: quá trình oxi hoá
: quá trình khử
Lời giải:
1)
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Câu 2: Cân bằng phản ứng oxi hoá khử bằng phương pháp thăng bằng electron:
1) NO2 + NaOH → NaNO2 + NaNO3 + H2O
2) Cl2 + NaOH → NaCl + NaClO3 + H2O
Lời giải:
1)
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Câu 3: Cân bằng các PTHH sau:
a. Fe + HNO3 → Fe(NO3)3 + N2 + H2O
b. Mg + HNO3 → Mg(NO3)2 + NO + H2O
c. FexOy + H2 → FeO + H2O
d. CxHy + O2 → CO2 + H2O
e. KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Lời giải:
a. 10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2 + 18H2O
b. 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
c. FexOy + (y – x)H2 xFeO + (y – x)H2O
d. CxHy +( ) O2 xCO2 + H2O
e. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu 4: Cân bằng PTHH hợp chất hữu cơ tổng quát:
1) CnH2n + O2 → CO2 + H2O
2) CnH2n+2 + O2 → CO2 + H2O
3) CnH2n-2 + O2 → CO2 + H2O
4) CnH2n-6 + O2 → CO2 + H2O
5) CnH2n+2O + O2 → CO2 + H2O
Lời giải:
1) CnH2n + O2 nCO2 + nH2O
2) CnH2n+2 + O2 nCO2 + (n+1)H2O
3) CnH2n-2 + O2 nCO2 + (n – 1)H2O
4) CnH2n-6 + O2 nCO2 + (n – 3)H2O
5) CnH2n+2O + O2 nCO2 + (n +1)H2O
A. 15,66. 1024;
B. 15,66. 1021;
C. 15,66. 1022;
D. 15,66. 1023.
Lời giải:
Đáp án đúng là: D
0,1 mol sắt → 0,1. 6,022.1023 = 6,022.1022 nguyên tử sắt
Số electron = 6,022.1022. 26 = 15,6572.1023 electron.
A. Ca;
B. Mg;
C. Cu;
D. Ba.
Lời giải:
nNH4NO3 + M(OH)n → M(NO3)n + nNH3 +nH2O
0,2/n 0,2
→ Mmuối = MM + 62n =
→ MM = 68,5n
→ n = 2 và M là bari (Ba).
Lời giải:
Gọi công thức của oxit là FexOy
Phản ứng xảy ra:
Ta có:
Vậy oxit là Fe3O4.
Lời giải:
Gọi phần trăm của đồng vị 79Br là x %;
phần trăm của đồng vị 81Br là (100−x)%
Nguyên tử khối trung bình:
→ x = 54
Phần trăm của đồng vị 81Br là 46%.
Xét 1 mol NaBr có:
1 mol Br → 0,46 mol 81Br
A. 0,06 M;
B. 0,08 M;
C. 0,60 M;
D. 0,10 M.
Lời giải:
A. Zn;
B. Mg;
C. Fe;
D. Cu.
Lời giải:
nNO = 1,12 : 22,4 = 0,05 mol
3R + 8HNO3 → 3R(NO3)2 + 2NO + 4H2O
Theo phương trình ta có:
⇒ R = 4,8 : 0,075 = 64 ⇒ Cu
Câu 11: Cấu hình electron bền vững, bão hoà, bán bão hoà là gì?
Lời giải:
Cấu hình bền vững là cấu hình của khí hiếm. Khi mà số electron lớp vỏ bằng 8 (ngoại trừ He).
Ví dụ: Ar có cấu hình là 1s2 2s22p6 3s23p6
Ion Na+ có cấu hình là 1s2 2s22p6
Cấu hình bão hoà là khi phân lớp đạt số electron tối đa. Ví dụ phân lớp s điền đủ 2 e, p điền đủ 6 e, d điền đủ 10 e.
Ví dụ: Mg có cấu hình 1s2 2s22p6 3s2
Cấu hình bán bão hoà là khi phân lớp đạt một nửa số electron tối đa.
Ví dụ: P có cấu hình là 1s2 2s22p6 3s23p3
Lời giải:
Ni thuộc ô 28, nhóm VIIIB
Cấu hình electron: 1s22s22p63s23p63d104s1
Ni2+: 1s22s22p63s23p63d9
Ni3+: 1s22s22p63s23p63d8.
Câu 13: Cấu hình electron lớp ngoài cùng của nguyên tố nhóm VA là:
A. ns2np5;
B. ns2np3;
C. ns2np2;
D. ns2np4.
Lời giải:
Đáp án đúng là: B
Cấu hình electron lớp ngoài cùng của nguyên tố nhóm VA là ns2np3.
A.Trong phản ứng hoá học, các nguyên tử bị phá vỡ;
B.Trong phản ứng hoá học, liên kết trong các phân tử bị phá vỡ;
C.Trong phản ứng hoá học, liên kết trong các phân tử không bị phá vỡ;
D.Trong phản ứng hoá học các phân tử được bảo toàn.
Lời giải:
Đáp án đúng là: B
Trong phản ứng hoá học liên kết giữa các nguyên tử bị phá vỡ, các nguyên tử được bảo toàn.
Câu 15: Có cách nào để phân biệt khi nào sắt hoá trị II, III?
Lời giải
+ Khi Fe tác dụng với các chất có tính oxi hóa mạnh như: F2, Cl2, H2SO4 đặc, nóng, HNO3 … thì sản phẩm của Fe sẽ có hóa trị (III).
+ Khi tác dụng với các chất không có tính oxi hóa hoặc tính oxi hóa yếu như S, HCl, H2SO4 loãng thì sản phẩm của Fe sẽ có hóa trị (II).
A. C3H7NH2;
B. (CH3)3N;
C. C2H5NH2;
D. CH3NH2.
Lời giải
Đáp án đúng là: D
Áp dụng định luật bảo toàn khối lượng, ta có:
mamin + mHCl = mmuối
→ mHCl = mmuối – mamin = 13,5 – 6,2 = 7,3 (gam)
Amin no, đơn chức, mạch hở nên có công thức là CnH2n+1NH2.
Phương trình: CnH2n+1NH2 + HCl → CnH2n+2Cl
namin = nHCl = 0,2 (mol)
Vậy amin cần tìm là CH3NH2.
Câu 17: Cân bằng phản ứng hoá học:
CH3CH2OH + KMnO4 + H2SO4 → CH3COOH + MnSO4 + H2O + K2SO4
Lời giải:
Chất khử: CH3CH2OH; chất oxi hoá: KMnO4.
Ta có các quá trình:
Phương trình hoá học:
5CH3CH2OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 +11H2O + 2K2SO4
Câu 18: CH3COOK là chất điện li mạnh hay yếu?
Lời giải:
CH3COOK là chất điện li mạnh.
Phương trình điện li: CH3COOK → CH3COO- + H+
Câu 19: Tại sao CH3COOH là chất điện li yếu còn CH3COONa là chất điện li mạnh?
Lời giải:
Có 2 yếu tố quyết định nên khả năng điện li của CH3COOH và CH3COONa
1. Độ âm điện.
Độ âm điện của H: 2,2
Độ âm điện của Na: 0,93
⇒ Xét 1 cách tương đói, liên kết giữa O và Na trong phân tử CH3COONa phân cực hơn so với liên kết cộng hóa trị giữa O và H trong CH3COOH nên khả năng phân li tốt hơn.
2. Liên kết hidro
Trong phân tử CH3COOH tồn tại liên kết hidro giữa các phân tử axit ⇒ làm cho phân tử bền, khó phân li.
Giữa các phân tử CH3COONa không có liên kết hidro.
A. C6H7N;
B. C6H9N;
C. C7H9N;
D. C5H7N.
Lời giải:
Đáp án đúng là: A
MA = 3,21. 29 = 93 (g/mol)
Bảo toàn nguyên tố C:
Bảo toàn nguyên tố H:
Bảo toàn nguyên tố N:
Đặt CTPT của A là CxHyNz
CTPT của A là: (C6H7N)n
→ (6. 12 + 7 + 14). n = 93
→ n = 1
Vậy CTPT của A là C6H7N.
Câu 21: Trong thực tế người ta thực hiện phản ứng tráng gương đối với chất nào sau đây để tráng ruột bình thuỷ tinh?
A. Anđehit fomic;
B. Anđehit axetic;
C. Glucozơ;
D. Axit fomic.
Lời giải:
Đáp án đúng là: C
Trong thực tế người ta thực hiện phản ứng tráng gương đối với glucozơ để tráng ruột bình thuỷ tinh vì giá thành thấp, dễ tìm, dễ bảo quản, dễ điều chế, không độc.
Câu 22: Oxit nào thường dùng làm chất hút ẩm trong phòng thí nghiệm? Giải thích?
Lời giải:
Các oxit CaO, BaO, P2O5 có thể làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm.
Vì các oxit này dễ dàng tác dụng được với nước (hơi nước).
Các phương trình hóa học :
CaO + H2O → Ca(OH)2
BaO + H2O → Ba(OH)2
P2O5 + 3H2O → 2H3PO4
Câu 23: Chất ít tan trong nước là?
A. NaCl;
B. NH3;
C. CO2;
D. HCl.
Lời giải:
Đáp án đúng là: C
Chất ít tan trong nước là CO2.
Câu 24: Chất khí A có công thức hoá học của A là:
A. SO2;
B. CO2;
C. NH3;
D. N2.
Lời giải:
Đáp án đúng là: D
Vậy công thức hoá học của A là N2.
Lời giải:
- Trích mỗi chất ra 1 ít để làm mẫu thử
- Cho dung dịch Ba(OH)2 vào từng mẫu thử trên, nhận:
+ (NH4)2SO4 vừa có kết tủa trắng tạo thành và có khí mùi khai thoát ra
Ba(OH)2 + (NH4)2SO4 → BaSO4↓ + 2NH3↑ + 2H2O
+ Na2SO4 có kết tủa trắng tạo thành
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
+ NH4NO3 có khí mùi khai thoát ra
Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3↑ + 2H2O
+ Còn lại là NaCl không phản ứng.
Câu 26: Chỉ dùng các kim loại hãy nhận biết các dung dịch sau: NaNO3, HCl, NaOH, HNO3, CuSO4.
Lời giải:
Cho Fe vào các chất.
- NaNO3, NaOH không hiện tượng.
- HCl hoà tan Fe tạo khí không màu.
Fe + 2HCl → FeCl2 + H2
- HNO3 có khí không màu, hoá nâu trong không khí.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
- CuSO4 có chất rắn màu đỏ.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Nhỏ CuSO4 vào 2 dung dịch còn lại.
- NaOH có kết tủa xanh.
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
- Còn lại NaNO3.
Câu 27: Chỉ dùng quỳ tím, nhận biết các chất sau:
a) 6 dung dịch: H2SO4, HCl, NaOH, Ba(OH)2, NaCl, BaCl2.
b) 6 dung dịch: Na2SO4, NaOH, BaCl2, HCl, AgNO3, MgCl2.
c) 4 dung dịch: Na2CO3, AgNO3, CaCl2, HCl.
Lời giải:
a) 6 dung dịch: H2SO4, HCl, NaOH, Ba(OH)2, NaCl, BaCl2
- Dùng quỳ tím để nhận biết:
+ Quỳ tím hoá đỏ: HCl, H2SO4 (A)
+ Quỳ tím hoá xanh: NaOH, Ba(OH)2 (B)
+ Quỳ tím không đổi màu: NaCl, BaCl2 (C)
- Lấy 1 chất bất kì ở nhóm A cho vào nhóm B. Nếu có kết tủa trắng thì chất ở nhóm A là H2SO4, chất ở nhóm B là Ba(OH)2 → Chất còn lại ở nhóm A là HCl, chất còn lại ở nhóm B là NaOH.
H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
- Dùng H2SO4 nhận ra 2 chất ở nhóm C, có kết tủa là BaCl2, còn lại là NaCl
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
b) 6 dung dịch: Na2SO4, NaOH, BaCl2, HCl, AgNO3, MgCl2
- Dùng quỳ tím để nhận biết:
+ Quỳ tím hoá đỏ: HCl, AgNO3, MgCl2 (A)
+ Quỳ tím hoá xanh: NaOH
+ Quỳ tím không đổi màu: Na2SO4, BaCl2 (B)
- Cho NaOH vào nhóm A:
+ Kết tủa trắng là MgCl2:
2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl
+ Kết tủa đen là AgNO3
2AgNO3 + 2NaOH → 2NaNO3 + Ag2O↓ + H2O
+ Trong suốt, không hiện tượng là HCl
HCl + NaOH → NaCl + H2O
- Cho AgNO3 vào nhóm B:
+ Kết tủa trắng hoàn toàn là BaCl2:
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
+ Có thể kết tủa trắng một phần nhỏ là Na2SO4
Na2SO4 + 2AgNO3 → 2NaNO3 + Ag2SO4
c) 4 dung dịch: Na2CO3, AgNO3, CaCl2, HCl.
- Dùng quỳ tím để nhận biết:
+ Quỳ tím hoá đỏ: HCl, AgNO3 (A)
+ Quỳ tím hoá xanh: Na2CO3
+ Quỳ tím không đổi màu: CaCl2
- Cho Na2CO3 vào A:
+ Có khí là HCl:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
+ Có kết tủa là AgNO3:
Na2CO3 + 2AgNO3 → Ag2CO3↓ + 2NaNO3
Câu 28: Chỉ dùng một thuốc thử phân biệt các kim loại sau: Mg, Zn, Fe, Ba?
A. Nước.
B. Dung dịch loãng.
C. Dung dịch NaCl.
D. Dung dịch NaOH.
Lời giải:
Đáp án đúng là: B
- Trích mẫu thử. Cho lần lượt các mẫu thử vào dung dịch H2SO4.
+ Mẫu thử sủi bọt khí không màu đồng thời xuất hiện ↓ trắng là Ba
Ba + H2SO4 → BaSO4↓ + H2↑
+ Mẫu thử chỉ sủi bọt khí không màu là Mg, Zn và Fe.
Mg + H2SO4 → MgSO4 + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
- Cho tiếp Ba dư vào rồi lọc bỏ kết tủa → thu được dung dịch chỉ chứa Ba(OH)2
- Lấy dung dịch này cho từ từ đến dư vào các dung dịch sản phẩm phía trên:
+ Dung dịch cho ↓ trắng → dung dịch là MgSO4 → mẫu thử là Mg.
Ba(OH)2 + MgSO4 → BaSO4↓ + Mg(OH)2↓
+ Dung dịch cho ↓ xanh trắng → dung dịch là FeSO4 → mẫu thử là Fe.
Ba(OH)2 + FeSO4 → BaSO4↓+ Fe(OH)2↓
+ Dung dịch cho ↓ keo trắng lẫn kết tủa trắng rồi tan một phần → dung dịch là ZnSO4 → mẫu thử là Zn.
Ba(OH)2 + ZnSO4 → BaSO4↓ + Zn(OH)2↓
Zn(OH)2 + Ba(OH)2 → BaZnO2 + 2H2O
Câu 29: Chia 38,6 gam hỗn hợp gồm Fe và kim loại M có hóa trị duy nhất thành 2 phần bằng nhau:
Phần 1: Tan vừa đủ trong 2 lít dung dịch HCl thấy thoát ra 14,56 lít H2 (đktc).
Phần 2: Tan hoàn toàn trong dung dịch HNO3 loãng nóng thấy thoát ra 11,2 lít khí NO duy nhất (đktc).
Kim loại M là:
A. Mg;
B. Fe;
C. A1;
D. Cu.
Lời giải:
Đáp án đúng là: C
Gọi nFe = x; nM = y (mol; x,y > 0)
Vì Fe và kim loại M có hóa trị duy nhất tan trong HCl và HNO3 nên áp dụng định luật bảo toàn electron ta có:
Mà (2)
Từ (1) và (2)
Vậy M là nhôm (Al).
- Phần 1: Phản ứng với dung dịch HCl dư, thu được 2,128 lít H2 (đktc)
- Phần 2: Phản ứng với HNO3 thu được 1,972 lít NO (đktc) là sản phẩm khử duy nhất.
Xác định kim loại R.
Lời giải:
Gọi nFe = a (mol); nR = b (mol)
Gọi n là hóa trị của kim loại R
⇒
Fe + 2HCl → FeCl2 + H2
2R + 2nHCl → 2RCln + nH2
Theo PTHH :
Phần 2 :
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3R + 4nHNO3 → 3R(NO3)n + nNO + 4nH2O
Theo PTHH :
Từ (1) (2) và (3) suy ra:
a = 0,05; MRb = 0,81; bn = 0,09 ⇔
⇒
Nếu n = 1 thì MR = 9 → Loại
Nếu n = 2 thì MR = 18 → Loại
Nếu n = 3 thì MR = 27(Al)
Vậy, kim loại R là Al.
A.11,8 gam NaH2PO4;
B.14,2 gam Na2HPO4 và 16,4 gam Na3PO4;
C.11,8 gam NaH2PO4 và 16,4 gam Na3PO4;
D.11,8 gam NaH2PO4 và 14,2 gam Na2HPO4.
Lời giải
Đáp án đúng là: B
Nhận thấy:
→ tạo hai muối
Na2HPO4 (a mol) và Na3PO4 (b mol)
Bảo toàn nguyên tố Na:
→ 2a + 3b = 0,5 (1)
Bảo toàn nguyên tố P:
→ a + b = 0,2 (2)
Từ (1) và (2) suy ra: a = b = 0,1
A. 1,56 gam;
B. 19,43 gam;
C. 17,87 gam;
D. 20,2 gam.
Lời giải:
Đáp án đúng là: C
= 0,04 mol; = 0,08 mol; = 0,14 mol; = 0,07 mol.
= 0,07 mol;
= 0,02 (mol)
Vậy kết tủa gồm Al(OH)3 và BaSO4 có tổng khối lượng = 78.0,02 + 233.0,07 = 17,87 gam.
A. 54,18%.
B. 32,88%.
C. 58,84%.
D. 50,31%.
Lời giải:
Lời giải:
Đáp án đúng là: D
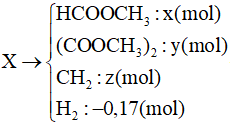
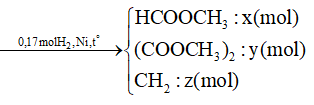
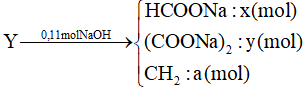
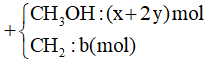
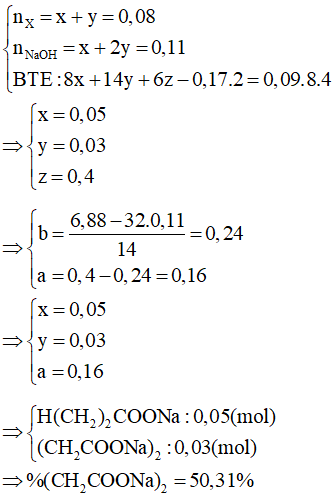
A. 400;
B. 100;
C. 300;
D. 200.
Lời giải:
Đáp án đúng là: A
Bỏ qua bước trung gian tạo dung dịch X, ta coi như cho lần lượt Lysin (0,1 mol) và NaOH (0,2 mol) tác dụng với HCl.
PTHH:
HOOCR(NH2)2 + 2HCl → muối
NaOH + HCl → NaCl + H2O
Theo các PTHH: = 2.0,01 + 0,02 = 0,04 mol
⇒VHCl = 0,04 l = 400 ml.
A. NaHCO3
B. KHCO3
C. Na2CO3
D. K2CO3
Lời giải:
Đáp án đúng là: C
Ta có:
- TH1: Muối cacbonat trung hòa:
Đặt công thức của muối là R2CO3
R2 CO3+ 2HCl → 2RCl+ CO2+ H2O
Theo PTHH:
→
→ MR= 23 → Na → Na2CO3
- TH2: Muối cacbonat axit
Đặt công thức của muối là RHCO3
RHCO3+ HCl → RCl+ CO2+ H2O
Theo PTHH: nRHCO3= nCO2= 0,005 mol
→ MRHCO3= 0,53/ 0,005=106
→ MR= 465 → Loại.
Lời giải:
Gọi kí hiệu, nguyên tử khối của kim loại là M.
M + 2H2O → M(OH)2 + H2.
= 0,015 (mol)
→ . Suy ra nguyên tử khối là 40u.
Vậy nguyên tố kim loại là Ca.
Lời giải:
= 0,25.0,16=0,04(mol)
Gọi nAl = a (mol); nMg = b (mol)
⇒ 27a + 24b = 0,765 (1)
Gọi bị hoà tan = c (mol)
nNaOH = 0,25.0,34 = 0,085 (mol)
2NaOH + H2SO4 → Na2SO4 + 2H2O
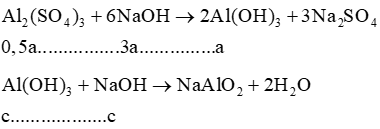
Ta có:
bị hoà tan
→ (0,04 – 1,5 a – b).2 + 2b + 3a + c = 0,085 → c = 0,085 (2)
⇔ 58b + (a−c).78 = 1,65
⇔78a + 68b − 78c = 1,65 (3)
Từ (1) (2) và (3) suy ra a = 0,015; b = 0,015; c = 0,005
Vậy dung dịch X chứa :
Al2(SO4)3: 0,5a = 0,0075(mol)
MgSO4: b=0,015
H2SO4 dư: 0,04 − 1,5a − b = 0,0025 (mol)
Suy ra :
= 0,075.2 = 0,015 (mol)
= 0,015 (mol)
= 0,0075.3 + 0,015 + 0,0025 = 0,04
= 0,0025.2 = 0,005 (mol)
⇒ = 0,04 (mol)
⇒ (lít)
nKOH = 0,4.0,8 = 0,32 (mol)
Suy ra:
= 0,32 + 0,04.2 = 0,4(mol)
Số mol phản ứng với là :
Vậy Al(OH)3 bị hòa tan kết
Suy ra kết tủa gồm: Mg(OH)2 0,015 mol; BaSO4: 0,04 mol
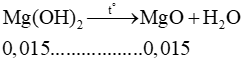
Vậy :
M = 0,015.40 + 0,04.233 = 9,92(gam).
Lời giải:
Phương trình:
Vậy X là canxi (Ca).
A. Xác định 2 kim loại đó?
B. Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp
Lời giải:
a, Gọi 2 kim loại đó là M
M + 2H2O → M(OH)2 + H2↑
0,03 0,03
⇒ ⇒ 2 kim loại là Mg và Ca
b, gọi nMg = x; nCa = y
⇒ Ta có : x+ y = 0,03; 24x+ 40y = 1,04
⇒ x= 0,01 ; y = 0,02
⇒ ; %mCa = 100% - 23,1% = 76,9%
A. Be.
B. Mg.
C. Ca.
D. Ba.
Lời giải:
Đáp án đúng là: C
Phương trình: M + 2HCl → MCl2 + H2
Vậy kim loại là canxi (Ca).
Lời giải:
Đặt x, y, z lần lượt là số mol Cu, Mg, Al.
Quá trình nhường e :
Cu → Cu2+ + 2e
x → x → 2x
Mg → Mg2+ + 2e
y → y → 2y
Al → Al3+ + 3e
z → z → 3z
Quá trình thu e:
0,03…0,01
0,04…0,04
Ta có : 2x + 2y + 3z = 0,03 + 0,04 = 0,07 và 0,07 cũng chính là số mol NO3- tạo muối.
Khối lượng muối nitrat là : 1,35 + 62 × 0,07 = 5,69 (gam).
Lời giải:
a) Các phương trình hóa học:
2Al + H2SO4 → Al2(SO4)3 + 3H2
Fe + H2SO4 → FeSO4 + H2
b)
Đặt nAl = x, nFe = y
Ta có hệ phương trình: 27x + 56y = 16, 6 và 1,5x + y = 0,5
Giải hệ được: x = y = 0,2 mol.
Suy ra mAl = 0,2.27 = 5,4g
% mFe = 67,47%
Lời giải:
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3
Suy ra có dung dịch NaOH dư
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Suy ra có dung dịch NaOH dư
Câu 44: Cho 10,8 gam nhôm tác dụng với dung dịch axit sunfuric H2SO4 10%.
a) Tính khối lượng muối tạo thành và thể tích khí hidro thoát ra ở đktc.
b) Tính khối lượng dung dịch H2SO4 đã dùng.
Lời giải:
Ta có pthh
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Theo đề bài ta có
a, Theo PTHH:
b, Khối lượng dung dịch H2SO4 là:
a) Viết phương trình hoá học phản ứng xảy ra.
b) Tính thể tích H2 sinh ra ở đktc.
c) Nếu cho toàn bộ lượng khí H2 ở trên khử 0,3 mol CuO. Tính lượng đồng kim loại sinh ra.
Lời giải
a) Zn + 2HCl → ZnCl2 + H2
b)
PTHH: Zn + 2HCl → ZnCl2 + H2
0,2→0,4 →0,2→ 0,2
c)
PTHH: CuO + H2 Cu + H2O
Xét tỉ lệ: => CuO dư, H2 hết
PTHH: CuO + H2 Cu + H2O
0,2……….0,2
=> mCu = 0,2.64 = 12,8 (g).
A. 4,54g.
B. 7,44g.
C. 7,02g.
D. 9,5g.
Lời giải:
Đáp án đúng là: D
Khối lượng muối nitrat của kim loại
= mkim loại + tạo muối
= mkim loại + 62.ne nhường
= 2,06 + 62.0,04.3 = 9,5g
Lời giải:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Lời giải:
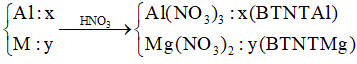
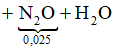
Quá trình cho và nhận e:
Ta có hệ phương trình:
Vậy m = 12,78 + 1,48 = 14,26 (g).
Câu 50: Cho 1,82 gam hỗn hợp MgO và Al2O3 tác dụng vừa đủ với 250 ml dung dịch H2SO4 0,2M.
a) Viết phương trình phản ứng hóa học
b) Tính thành phần % khối lượng của mỗi oxit trong hỗn hợp.
Lời giải:
MgO + H2SO4 → MgSO4 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 +3H2O
Gọi số mol MgO; Al2O3 lần lượt là x; y.
→40x +102y = 1,82 gam
Ta có:
Giải được: x = 0,02; y = 0,01
→mMgO = 0,02.40 = 0,8 gam
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.