Top 1000 câu hỏi thường gặp môn Hóa Học có đáp án (phần 19) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa Học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 19)
Câu 1: Dung dịch nào sau đây có pH nhỏ nhất?
A. Na2CO3;
B. Na3PO4;
C. Ca(OH)2;
D. HCl.
Lời giải
Đáp án đúng là: D
Na2CO3 có tính bazơ → pH > 7.
Na3PO4 có tính bazơ → pH > 7.
Ca(OH)2 có tính bazơ → pH > 7.
HCl có tính axit → pH < 7.
Câu 2: Dung dịch NaOH có thể tác dụng với tất cả các chất trong nhóm nào sau đây?
A. Al, HCl, CaCO3, CO2;
B. FeCl3, HCl, Ca(OH)2, CO2;
C. CuSO4, Ba(OH)2, CO2, H2SO4;
D. FeCl2, Al(OH)3, CO2, HCl.
Lời giải
Đáp án đúng là: D
Loại A vì có CaCO3 không phản ứng với NaOH.
Loại B vì có Ca(OH)2 không phản ứng với NaOH
Loại C vì có Ba(OH)2 không phản ứng với NaOH.
Câu 3: Dung dịch axit photphoric có chứa các ion (không kể H+ và OH- của nước):
A. H+, PO43-.
B. H+, H2PO4-, PO43-.
C. H+, HPO42-, PO43-.
D. H+, H2PO4-, HPO42-, PO43-.
Lời giải
Đáp án đúng là: D
H3PO4 là axit 3 nấc. Trong dung dịch nước H3PO4 phân li theo từng nấc:
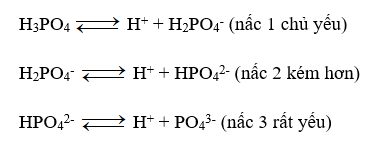
Câu 4: Dung dịch nào sau đây tác dụng được với dung dịch Mg(NO3)2?
A. AgNO3.
B. HCl.
C. KOH .
D. KCl
Lời giải
Đáp án đúng là: C
Mg(NO3)2 + 2KOH → Mg(OH)2↓ + 2KCl
A. 0,32M.
B. 0,1M.
C. 0,23M.
D. 1M.
Lời giải
Đáp án đúng là: A
nNaOH = 0,04 mol và = 0,06 mol
Phương trình phân li:
NaOH → Na+ + OH-
0,04 → 0,04 mol
Na2SO4 → 2Na+ + SO42-
0,06 → 0,12 mol
→ nNa+ = 0,16 mol → [Na+] = 0,16 : 0,5 = 0,32 M.
A. 0,7;
B. 15,68;
C. 21,28;
D. 1,9.
Lời giải
Đáp án đúng là: D
Dung dịch X chứa 21,6 gam hỗn hợp gồm glixerol và etylenglicol có tỉ lệ mol tương ứng 1 : 2, nếu gọi nglixerol = x (mol), ta có:
92.x + 62. 2x = 21,6 → x = 0,1
→ nglixerol = 0,1 (mol); netylenglicol = 0,2 (mol)
Mà dung dịch X chứa 21,6 gam hỗn hợp gồm glixerol và etylenglicol có tỉ lệ mol tương ứng 1:2 có nồng độ 50% nên
Ta có:
Vậy
Câu 7: Một dung dịch X có pH = 4,5 . Nồng độ H+ (ion/lít) trong dung dịch là?
Lời giải
pH = 4,5 →.
A. Fe;
B. Zn;
C. Cu;
D. Mg.
Lời giải
Đáp án đúng là: B
Dùng kẽm vì có phản ứng:
Zn + CuSO4 → ZnSO4 + Cu ↓
Nếu dùng dư Zn thì Cu tạo thành không tan được tách ra khỏi dung dịch và thu được dung dịch ZnSO4 tinh khiết.
Câu 9: Chỉ dùng 1 thuốc thử, trình bày nhận biết: BaSO4, BaCO3, Na2CO3, Na2SO4, MgCO3, CuSO4.
Lời giải
- Lấy mỗi chất một lượng nhỏ làm mẫu thử.
- Cho từng chất tác dụng với dung dịch H2SO4 dư:
+ Không tan trong H2SO4: BaSO4
+ Tan, có khí không màu và kết tủa trắng: BaCO3
+ Tan, tạo dung dịch trong suốt: Na2SO4
+ Tan, tạo dung dịch màu xanh: CuSO4
+ Tan, có khí bay ra, dung dịch trong suốt: Na2CO3; MgCO3
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
- Cho 2 chất chưa phân biệt đến được vào từng dung dịch chứa 2 chất chưa phân biệt
+ Chất rắn tan hết, có khí bay ra: Na2CO3
+ Khí bay ra hết, chất rắn có 1 phần không tan: MgCO3.
Câu 10: Chỉ dùng H2SO4 loãng nhận biết các dung dịch sau: BaSO4, BaCO3, Na2CO3, NaCl?
Lời giải
- Cho H2SO4 vào 4 mẫu thử:
+ Không tan trong H2SO4 là BaSO4
+ Tạo kết tủa và khí bay lên là BaCO3
BaCO3 + H2SO4→ BaSO4↓ + CO2↑ + H2O
+ Tan và tạo khí là Na2CO3
Na2CO3 + H2SO4 → 2NaCl + CO2↑ + H2O
+ Không hiện tượng là NaCl.
Câu 11: Viết 6 phương trình phản ứng điều chế NaOH từ Na và các hợp chất của Na?
Lời giải
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaCl + 2H2O 2NaOH + H2 + Cl2
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3↓
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
Na2O2 + H2O → 2NaOH + O2
Câu 12: Dùng V lít khí CO khử hoàn toàn 4 gam một oxit kim loại, phản ứng kết thúc thu được kim loại và hỗn hợp khí X. Tỷ khối của X so với H2 là 19. Cho X hấp thụ hoàn toàn vào 2,5 lít dung dịch Ca(OH)2 0,025M người ta thu được 5 gam kết tủa.
a. Xác định kim loại và công thức hoá học của oxit đó.
b. Tính giá trị của V và thể tích của SO2 (đktc) tạo ra khi cho lượng kim loại thu được ở trên tan hết vào dung dịch H2SO4 đặc, nóng dư.
Lời giải
- Gọi CTHH của oxit kim loại là M2On (n∈N*)
Phản ứng khi dùng khí CO khử oxit kim loại:
M2On + nCO 2M + nCO2 (1)
Hỗn hợp khí X gồm: CO dư, CO2.
Áp dụng sơ đồ đường chéo, ta có:
- Khi hấp thụ hỗn hợp khí X (gồm CO, CO2) vào dung dịch chứa Ca(OH)2 thì có thể xảy ra các phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
CO2 + CaCO3 + H2O → Ca(HCO3)2 (3)
= 2,5.0,025 = 0,0625 (mol)
⇒ nên xét 2 trường hợp:
+ TH1: Ca(OH)2 dư, xảy ra phản ứng (2).
Khi đó,
nCO dư = 0,6.0,05 = 0,03 (mol)
Theo (1),
→ MM = 32n
Với n = 2, MM = 64 (g/mol) thì M: Cu (thỏa mãn).
Khi đó CTHH của oxit là CuO.
+ TH2: CO2 dư hòa tan 1 phần kết tủa, xảy ra phản ứng (2) hoàn toàn và 1 phần (3).
Theo (2),
nCO dư = 0,6.0,075 = 0,045 (mol)
Theo (1),
→ MM = (g/mol)
Với n = 3, MM = 56 (g/mol) thì M: Fe (thỏa mãn).
Khi đó CTHH của oxit là Fe2O3.
b, Phản ứng khử oxit kim loại bởi CO:
M2On + nCO 2M + nCO2
Do đó nCO pứ =
+ Với trường hợp oxit kim loại phản ứng là CuO, =0,05 (mol)
thì nCO pứ = 0,05 (mol)
nCO bđ = 0,05 + 0,03 = 0,08 (mol)
V = 0,08.22,4 = 1,792 (l)
+ Với trường hợp oxit kim loại phản ứng là Fe2O3, = 0,075 (mol)
thì nCO pứ = 0,075 (mol)
nCO bđ = 0,075 + 0,045 = 0,12 (mol)
V = 0,12.22,4 = 2,688 (l)
Câu 13: Dự đoán khả năng tan trong nước của khí oxygen, lấy ví dụ minh chứng cho dự đoán đó.
Lời giải
- Oxygen tan ít trong nước
Ví dụ: Cá có thể sống dưới nước nhờ oxygen có thể hòa tan được trong nước.
Câu 14: Đại lượng đặc trưng của nguyên tử là:
A. Số proton và điện tích hạt nhân;
B. Số proton và số electron;
C. Số khối A và số nơtron;
D. Số khối A và điện tích hạt nhân.
Lời giải
Đáp án đúng là: D
Đại lượng đặc trưng của nguyên tử là số khối A và điện tích hạt nhân.
a) Xác định tên kim loại và oxit kim loại
b) Tính khối lượng muối sinh ra sau phản ứng, biết rằng lượng oxit và lượng axit tham gia vừa đủ?
Lời giải
Gọi CTHH của hợp chất là A2O3
A2O3 + 3H2SO4 →A2(SO4)3 + 3H2O
Theo PTHH ta có:
Vậy A là Al, CTHH của oxit là Al2O3.
Lời giải
Bảo toàn C:
Số C
→ Hai ankan là C3H8 và C4H10
→ x + y = 0,5 (1)
Bảo toàn C:
(1)(2) → x = 0,1 (mol);y = 0,4 (mol)
1. Xác định công thức đơn giản nhất của chất X.
2. Xác định công thức phân tử của X biết rằng tỉ khối hơi của X đối với C2H6 là 3,80.
Lời giải
1.
Mà sản phẩm cháy chỉ có CO2 và H2O theo tỉ lệ 44 : 15 về khối lượng nên
Khối lương C: →
Khối lượng H: → nH = 0,25 (mol)
Khối lượng O: 2,85 - 1,80 - 0,25 = 0,80 (g)
Chất X có dạng CxHyOz
x : y : z = 0,150 : 0,25 : 0,050 = 3 : 5 : 1
Công thức đơn giản nhất của X là C3H5O.
2, MX = 3,80.30,0 = 114,0 (g/mol)
(C3H5O)n = 114; 57n = 114 ⇒ n = 2.
Công thức phân tử C6H10O2.
Lời giải
Định luật bảo toàn khối lượng: “Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng”
+) Phản ứng:
Theo ĐLBTKL ta có:
Vậy khối lượng oxi đã tham gia phản ứng là 48 gam.
a. Tính nồng độ mol của dung dịch HCl đã dùng
b. Tính thành phần phần trăm theo khối lượng của mỗi muối trong hỗn hợp ban đầu
c. Tính khối lượng muối thu được sau phản ứng.
Lời giải
a. Hỗn hợp 2 muối BaSO3 và BaSO4 vào dung dịch HCl chỉ xảy ra phản ứng sau:
BaSO3 + 2HCl → BaCl2 + H2O + SO2
b.
c.
Câu 20: Hòa tan 8 gam MgO vào 200 ml dung dịch HCl, phản ứng xảy ra vừa đủ.
a. Viết phương trình phản ứng xảy ra.
b. Tính nồng độ mol của dung dịch HCl cần dùng
Lời giải
a. PTHH: MgO + 2HCl → MgCl2 + H2O
b.
Theo PTHH: nHCl = 2nMgO = 2.0,2 = 0,4 (mol)
Câu 21: Để làm sạch khí N2 từ hỗn hợp khí gồm N2, SO2, có thể dùng dung dịch nào sau đây?
A. H2SO4;
B. Ca(OH)2;
C. NaHSO3;
D. CaCl2.
Lời giải
Đáp án đúng là: B
Ta có Ca(OH)2 tác dụng được với khí SO2 và không tác dụng với khí N2
⇒ Ca(OH)2 có thể làm sạch khí N2 từ hỗn hợp khí N2 và SO2
PTHH: Ca(OH)2 + SO2 → CaSO3 + H2O
Câu 22: Để làm sạch khí O2 từ hỗn hợp khí gồm SO2, O2, có thể dùng chất nào sau đây?
A. Ca(OH)2;
B. CaCl2;
C. NaHSO3;
D. H2SO4.
Lời giải
Đáp án đúng là: A
Để làm sạch khí O2 từ hỗn hợp gồm SO2 và O2 ta dùng dung dịch nước vôi trong (Ca(OH)2):
Dẫn hỗn hợp khí qua Ca(OH)2 thì SO2 phản ứng bị giữ lại còn O2 không phản ứng thoát ra.
Phương trình hóa học:
Ca(OH)2 + SO2 → CaSO3 + H2O
Câu 23: Để nhận biết các dung dịch: NaOH, KCl, NaCl, KOH cần dùng các thuốc thử là
A. quỳ tím, dung dịch AgNO3;
B. phenolphtalein;
C. quỳ tím, thử ngọn lửa bằng dây Pt;
D. phenolphtalein, dung dịch AgNO3.
Lời giải
Đáp án đúng là: C
Dùng quỳ tím thì:
+ Nhóm làm quỳ tím hoá xanh là NaOH, KOH (I)
+ Nhóm không làm quỳ tím đổi màu là: NaCl, KCl (II)
Thử ngọn lửa bằng dây Pt với từng nhóm:
+ Chất cho ngọn lửa màu vàng là hợp chất của Na.
+ Chất cho ngọn lửa màu tím là hợp chất của K.
Câu 24: Để phân biệt dung dịch Na2SO4 với dung dịch NaCl, ta dùng dung dịch.
B. NaOH;
C. KNO3;
D. BaCl2.
Lời giải
Đáp án đúng là: D
Dùng dd BaCl2 vì cho vào dd Na2SO4 có kết tủa trắng, còn cho vào dd NaCl thì không có hiện tượng gì.
Na2SO4 + BaCl2 → BaSO4 ↓ trắng+ 2NaCl
Lời giải
Số mol saccarozo
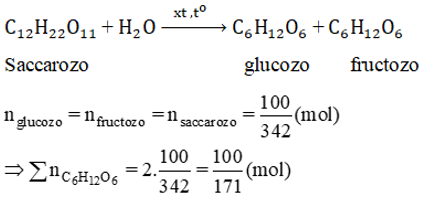
Cả glucozo và fructozo cùng tham gia phản ứng tráng gương:
C5H11O5CHO + 2AgNO3 + 3NH3 + H2O C5H11O5COONH4 + 2Ag + 2NH4NO3
Khối lượng Ag sinh ra và khối lượng AgNO3 cần dùng là
Câu 26: Để trung hòa 100ml dung dịch H2SO4 1M cần V ml NaOH 1M. Giá trị của V là
A. 200;
B. 150;
C. 50;
D.100.
Lời giải
Đáp án đúng là: A
Lời giải:
Sơ đồ phản ứng:
Ta có:
mFe = 1.84% = 0,84 tấn
Vì hiệu suất là 86%
(tấn)
→ mquặng = (tấn).
Lời giải:
Ta có mdd sau phản ứng = m1 + m2
Ta có
Lời giải:
Ta có:
Gọi a là số mol của Cu và b là số mol của Al.
Theo đề bài ta có hệ phương trình:
%mAl = 100% - 78,05% = 21,95%.
Câu 30: Điều chế: SO2, CaO, H2SO4, NaOH, Al, Fe (gang-thép)
Lời giải:
* Điều chế SO2:
- Trong PTN:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
- Trong công nghiệp:
* Điều chế CaO trong công nghiệp:
* Điều chế H2SO4 trong công nghiệp:
(Hoặc )
SO3 + H2O → H2SO4
* Điều chế NaOH trong công nghiệp:
* Điều chế Al trong công nghiệp:
* Điều chế Fe trong công nghiệp:
Mg + FeSO4 → MgSO4 + Fe
* Điều chế gang-thép trong công nghiệp:
- Điều chế gang: Dùng CO khử oxit sắt trong lò cao, sắt nóng chảy kết hợp với cacbon và một số phi kim tạo thành gang.
- Điều chế thép: Oxi hoá bớt một số nguyên tố trong gang như C,Mn,Si,...
Câu 31: Điều chế O2 trong phòng thí nghiệm bằng cách:
A. Nhiệt phân KClO3 có MnO2 xúc tác;
B. Điện phân nước;
C. Điện phân dung dịch NaOH;
D. Chưng cất phân đoạn không khí lỏng.
Lời giải:
Đáp án đúng là: A
Nguyên tắc điều chế O2 trong phòng thí nghiệm: Nhiệt phân các hợp chất giàu oxi và kém bền với nhiệt. Vậy để điều chế O2 trong phòng thí nghiệm người ta nhiệt phân KClO3 có MnO2 xúc tác.
Phương trình hóa học xảy ra: 2KClO3 2KCl + 3O2
Lời giải
Axit sunfuric để lâu ngoài không khí sẽ hút ẩm từ không khí, do đó khối lượng tăng lên.
A. 1,2 g.
B. 4,25 g.
C. 1,88 g.
D. 2,52 g.
Lời giải
Đáp án đúng là: A
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo phản ứng (1), số mol Cu:
→ mCu = 0,45.64 = 28,8 (g)
→ mCuO = 30 – 28,8 = 1,2 (g).
Câu 34: Cách để xác định được điều kiện bền của nguyên tử là gì?
Lời giải
Các hạt nguyên tử bền luôn có số proton, nơtron thoả mãn hệ thức p ≤ n ≤ 1,5p
Trong trường hợp không thoả mãn, nguyên tử đó thuộc về đồng vị phóng xạ của nguyên tố, không bền và dễ bị phân rã thành các hạt nhân khác nhỏ hơn.
Câu 35: Giải thích các hiện tượng ăn mòn kim loại như:
1. Đinh sắt trong không khí khô không bị ăn mòn.
2. Đinh sắt trong nước có hòa tan khí oxi ăn mòn chậm.
3. Đinh sắt trong dung dịch muối ăn NaCl bị ăn mòn nhanh.
4. Đinh sắt trong nước cất không bị ăn mòn.
Lời giải:
- Ăn mòn kim loại là sự phá hủy kim loại, hợp kim trong môi trường tự nhiên.
- Nguyên nhân: do kim loại tác dụng với những chất mà nó tiếp xúc trong môi trường (nước, không khí, đất)
Ví dụ:
Fe + 3Cl2 2FeCl3
3Fe + 4H2O Fe3O4 + 4H2
3Fe + 2O2 Fe3O4
- Sự ăn mòn kim loại không xảy ra hoặc xảy ra nhanh hay chậm phụ thuộc vào các chất có trong môi trường.
Ví dụ:
+ Đinh sắt trong không khí khô không bị ăn mòn
+ Đinh sắt trong nước có hòa tan oxi bị ăn mòn chậm
+ Đinh sắt trong dung dịch muối ăn bị hòa tan nhanh
+ Đinh sắt trong nước cất không bị ăn mòn
- Ở nhiệt độ cao sẽ làm cho sự ăn mòn xảy ra nhanh hơn
Câu 36: Công thức hóa học điphotpho pentaoxit là:
A. P2O5;
B. P2O3;
C. PO
D. P5O2.
Lời giải:
Tiền tố: đi = 2, penta = 5
Nên công thức hóa học điphotpho pentaoxit là P2O5.
Lời giải:
Ở 85oC, ,tức là:
87,7 gam CuSO4 tan tối đa trong 100 gam nước tạo thành 187,7 gam dung dịch bão hòa
Vậy x gam CuSO4 tan tối đa trong y gam nước tạo thành 1877 gam dung dịch bão hòa
⇒ y = 1877 – x = 1877 – 877 = 1000 (gam)
Gọi
Sau khi tách tinh thể :
Suy ra : Ở 12oC
⇒a = 4,0765
Câu 38: Độ tan của NaCl trong nước ở 20oC là 36 gam. Khi hòa tan 14 gam NaCl vào 40 gam nước thì phải hòa tan thêm bao nhiêu gam NaCl nữa để dung dịch bão hòa?
Lời giải:
Nồng độ khi dung dịch bão hoà:
Đặt mNaCl thêm = x (g)
Ta có:
Vậy cần thêm 0,42 gam NaCl.
Câu 39: Độ dinh dưỡng của phân lân là:
A. % Ca(H2PO4)2.
B. % P2O5.
C. % P.
D. %
Lời giải:
Đáp án đúng là: B
Độ dinh dưỡng của phân lân được đánh giá theo tỉ lệ phần trăm khối lượng P2O5 tương ứng với lượng P có trong thành phần của nó.
Lời giải:
nFe = 0,2 (mol); nHCl = 0,44 (mol); = 0,02 (mol)
Bảo toàn H:
m1 = mFe + mO = 14,4 gam
nAgCl = nHCl = 0,44 (mol)
Bảo toàn electron: 3nFe = 2nO + 2 + nAg → nAg = 0,16 (mol)
→ m2 = mAgCl + mAg = 80,42 gam.
A. CH2O2.
B. CH2O.
C. C2H5O.
D. C2H4O.
Lời giải:
Đáp án đúng là: D
= 0,2 (mol) ⇒ nC = 0,2 (mol) ⇒ mC = 2,4 (g)
= 0,2 (mol) ⇒ nH = 0,4(mol) ⇒ mH = 0,4 (g)
Ta có: mC + mH = 2,8 < 4,4
=> Trong phân tử X có chứa O
CTDC: CxHyOz
mO = 4,4 − 2,8 = 1,6 (g) ⇒ nO = 0,1 (mol)
x : y : z = 0,2 : 0,4 : 0,1 = 2 : 4 : 1
Công thức đơn giản nhất của hợp chất hữu cơ X là C2H4O.
Câu 42: Đốt cháy hoàn toàn 50,4 gam sắt trong bình chứa khí oxi thu được oxit sắt từ (Fe3O4).
a. Hãy viết phương trình phản ứng xảy ra
b. Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng
c. Tính khối lượng sản phẩm thu được
d. Tính khối lượng KClO3 cần dùng để phân huỷ thì thu được 1 thể tích khí O2 (ở đktc) bằng thể tích khí O2 đã sử dụng ở phản ứng trên.
Lời giải:
b. Ta có:
Theo phương trình
c. Theo phương trình:
A. 50% C2H4 và 50% C3H6;
B. 60% C2H4 và 40% C3H6;
C. 50% C3H6 và 50% C4H8;
D. 60% C4H8 và 40% C5H10.
Lời giải:
Đáp án đúng là: B
→ 2 anken là C2H4 (x mol) và C3H6 ( y mol)
Ta có: x + y = 0,25 và 2x + 3y = 2,4.0,25
→ x = 0,15
Lời giải:
m1tăng =
Dư Ca(OH)2 nên ta có:
Số
Số
Số
Vậy CTPT của X là C3H6O2.
Câu 45: Đốt cháy 2,8 lít khí hiđro trong không khí.
a) Viết PTHH?
b) Tính thể tích và khối lượng của khí oxi cần dùng
c) Tính khối lượng nước thu được (Thể tích thu được ở đktc).
Lời giải:
a) PTHH:
b)
Theo PTHH:
c) Theo PTHH:
Lời giải:
;
PTHH:
Lập tỉ lệ: → O2 dư, S hết
Theo PTHH:
Lời giải:
Nhận thấy: Khối lượng chất rắn trong bình tăng bằng chính khối lượng của Cl2 phản ứng.
PTHH: 2Al + 3Cl2 → 2AlCl3
Theo PTHH:
→ mAl = 0,04.27 = 1,08 (g).
A. C2H5ON hoặc C2H7O2N;
B. C2H5O2N;
C. C2H7O2N;
D. C2H5ON.
Lời giải
Gọi lần lượt là: x, y (mol)
→ x + y = 0,025 (1)
Mà MZ = 20,4.2 = 40,8 → mZ = 40,8.0,025 = 1,02 (g)
→ 44x + 28y = 1,02 (2)
Từ (1), (2) ta có hệ phương trình:
Gọi công thức của X là CxHaObNy
→ Công thức của X là C2HaObN (Với a,b Z; )
Khi đó:
Kết hợp với điều kiện trên ta chỉ có cặp nghiệm duy nhất thỏa mãn là: a = 7; b = 2.
Vậy CTPT của X: C2H7O2N.
a) Tìm phân tử khối của D
b) Xác định công thức phân tử của D
Lời giải
Đốt cháy hoàn toàn D thu được CO2; H2O nên D chứa C, H và có thể chứa O.
D có dạng CxHyOz
Bảo toàn nguyên tố O:
Vậy D là C3H8O → MD = 12.3 + 8 + 16 = 60 (g/mol).
Lời giải
Số
Số
→ D là C2H6, C2H6O, C2H6O2.
Công thức cấu tạo:
CH3 – CH3
CH3 – CH2 – OH; CH3 – O – CH3
CH2OH – CH2OH.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.