Top 1000 câu hỏi thường gặp môn Hóa Học có đáp án (phần 14) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa Học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 14)
A. 22%.
B. 42,3%.
C. 57,7%.
D. 88%.
Lời giải:
Đáp án đúng là: B
Số mol NaOH là:
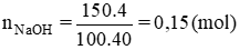
Gọi x, y lần lượt là số mol của CH3COOH và CH3COOC2H5
CH3COOH + NaOH → CH3COONa + H2O
CH3COOC2H5 + NaOH t°→ CH3COONa + C2H5OH
nNaOH = x + y = 0,15.
mhh = 60x + 88y = 10,4.
Giải hệ phương trình ta có x = 0,1; y = 0,05.
Khối lượng etyl axetat :
= 88 . 0,05 = 4,4(g)
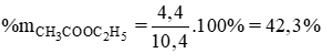
Lời giải:
Phương trình hóa học của phản ứng:
Cu + H2SO4 → Không phản ứng
Fe + H2SO4 → FeSO4 + H2
mFe = 0,1 x 56 = 5,6g.
Khối lượng Cu không hòa tan là
m = 10 - 5,6 = 4,4g
A. Ca, Sr;
B. Be, Mg;
C. Sr, Ba;
D. Mg, Ca.
Lời giải:
Đáp án đúng là: D
Gọi công thức chung 2 kim loại là M
M + 2HCl → MCl2 + H2
Mol 0,3 ← 0,3
=> Mtb = 10,4: 0,3 = 34,67 g/mol
=> 2 kim loại là Mg (24) và Ca (40).
Lời giải:
Gọi M là khối lượng mol của kim loại
2M + 3Cl2 → 2MCl3
10,8 g 53,4 g
Theo phương trình:
⇒ M = 27 (g). Vậy M là nhôm (Al)
A. K3PO4 và KOH;
B. KH2PO4 và K3PO4;
C. KH2PO4 và H3PO4;
D. KH2PO4 và K2HPO4.
Lời giải:
Đáp án đúng là: D
Ta có:
Giá trị này nằm trong khoảng (1,2)
Dung dịch chứa KH2PO4 và K2HPO4.
Lời giải:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Ag không phản ứng với H2SO4
a, Viết phương trình phản ứng
b, Tính khối lượng các chất có trong hỗn hợp
c, Tính thành phần trăm khối lượng mỗi kim loại trong hỗn hợp d, tính khối lượng dung dịch H2SO4 cần dùng.
Lời giải:
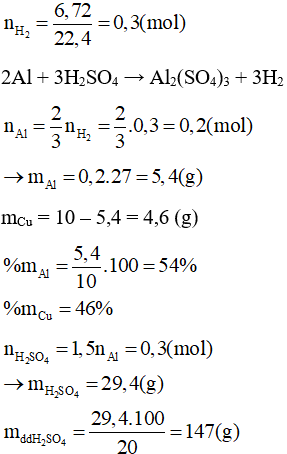
Lời giải:
Bảo toàn e: ne nhường = ne nhận = 3nNO = 3.0,3 = 0,9 (mol)
Đặt nAl = x (mol); nFe = y (mol)
Ta có:
mAl = 0,2.27 = 5,4 (g)
mFe = 0,1.56 = 5,6 (g)
Câu 9: Cho 11,2 gam Fe tác dụng với dung dịch HCl. Tính:
a, Thể tích khí H2 thu được ở đktc.
b, Khối lượng HCl phản ứng
c, Khối lượng FeCl2 tạo thành.
Lời giải:
Theo đề bài:
Phương trình: Fe + 2HCl → FeCl2 + H2
a) Theo phương trình:
b) Theo phương trình: nHCl = 2nFe = 0,2.2 = 0,4 (mol)
→ mHCl = 0,4. 36,5 = 14,6 (g)
c) Theo phương trình:
Lời giải:
Coi hỗn hợp A gồm Fe và O, nếu gọi mFe trong A = x (g, x>0)
→mO = 12,8 – x (g)
→
Quá trình cho và nhận electron:
Áp dụng bảo toàn electron, ta có:
Muối thu được là Fe2(SO4)3 có:
A. Mg
B. Ca
C. Fe
D. Ba
Lời giải:
Gọi nX= a (mol; a > 0)
X + Cl2 → XCl2
a a
Theo bài ra ta có: a.MX = 12
a.(MX + 71) = 47,5
Þ 71a = 47,5 - 12 = 35,5
=> a = 0,5 mol
→MX =12/0,5 = 24 (g/mol)
Vậy X là magie (Mg).
Câu 12: Cho 13,44 lít N2 (đktc) tác dụng với lượng dư khí H2. Biết hiệu suất của phản ứng là 25%, khối lượng NH3 tạo thành là?
A. 5,10 gam;
B. 6,12 gam;
C. 7,65 gam;
D. 40,80 gam.
Lời giải:
Đáp án đúng là: A
Ta có H = 25% nên:
Phương trình:
A. 63,16%;
B. 42,11%;
C. 36,84%;
D. 26,32%.
Lời giải:
Đáp án đúng là: A
Gọi nFe = a và nCu = b → 56x + 64y = 15,2
BT e: 3x + 2y = 3nNO = 0,6
→ x = 0,1 và y = 0,15
→ mCu = 9,6 (g)
→ %mCu = 63,16%.
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓
Ta có:
Lập tỉ lệ:
=> Ba(OH)2 hết
Theo PTHH:
Vậy khối lượng kết tủa thu được là: 3,495 + 0,78 = 4,275(g).
A. 36%;
B. 33,33%;
C. 64%;
D. 6,67%.
Lời giải
Đáp án đúng là: B
Phản ứng có thể tạo NH4NO3.
Đặt: nAl = x; nMg = y; = z (mol)
+ mhh = 27x + 24y = 15 (1)
+ mmuối = => 213x + 148y + 80z = 109,8 (2)
+ Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8
=> 3x + 2y = 3.0,2 + 8z (3)
Giải (1) (2) (3) => x = 0,2; y = 0,4; z = 0,1
=> %nAl = 0,2/(0,2+0,4) = 33,33%.
Câu 16: Cho 16,8 lít CO2 ở điều kiện tiêu chuẩn hấp thụ vào 600 ml NaOH 2M thu được dung dịch A.
a. Tính tổng khối lượng muối trong dung dịch A
b. Lấy dung dịch A tác dụng một lượng dư BaCl2.Tính khối lượng kết tủa thu được
Lời giải
Theo đề bài ta có
Ta xét tỉ lệ :
Ta có : 1 < T < 2 => Dung dịch A gồm 2 muối là Na2CO3 và NaHCO3
a) Gọi x ,y lần lượt là số mol của CO2 tham gia vào 2 phương trình:
Ta có PTHH :
(1)
(2)
Ta có hệ phương trình
=> mA = 47,7 + 25,2 = 72,9 (g)
b) Ta có :
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
0,45mol....................0,45mol
=> mkết tủa = = 0,45.197 = 88,65 (g).
Lời giải:
Metyl axetat là CH3COOCH3: C3H6O2
Etyl axetat: CH3COOC2H5: C4H8O2
Do là các este no đơn chức nên tác dụng với NaOH theo tỉ lệ 1:1
nNaOH = CM.V = 2.0,1 = 0,2 mol
Gọi x là , y là
Lập hệ phương trình:
b. Biết HNO3 dư 20%. Tính V dung dịch NaOH 2M cần để trung hòa X.
c. Cho NaOH 2M vào dung dịch X đến khi kết tủa max. Tính V NaOH?
Lời giải:
a. Gọi x, y là số mol Fe, Cu.
⇒56x + 64y = 17,6 (1)
Bảo toàn e: 3x + 2y = 0,8 (2)
Từ (1) và (2)⇒x = 0,2; y = 0,1
%mCu = 36,4%.
b. Dư 20% HNO3 nên chỉ phản ứng 80% HNO3 so với ban đầu.
phản ứng = = 3x + 2y + 0,8 = 1,6(mol)
⇒ dư = 0,4 (mol) = nNaOH
c. X chứa Fe(NO3)3 (0,2 mol), Cu(NO3)2 (0,1 mol), HNO3 (0,4 mol)
Lời giải:
Gọi số mol Fe; Cu lần lượt là x; y
Ta có:
mhh = mFe + mCu = 56x + 64y = 18,4 gam
Vì HNO3 đặc nóng dư nên khí sinh ra là NO2
Bảo toàn e:
3nFe + 2nCu = →3x + 2y = 0,7
Giải được: x = 0,1; y = 0,2
→mFe = 0,1.56 = 5,6 gam
→ %mCu = 69,6%.
A. 32,5% và 65,7%;
B. 65,7% và 32,5%;
C. 67,5% và 32,5%;
D. 32,5% và 67,5%.
Lời giải:
Đáp án đúng là: D
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x 3/2 x mol
Fe + H2SO4 → FeSO4 + H2
y y mol
⇒%mFe = 100% − 32,53% = 67,47%.
A. màu xanh;
B. không xác định được;
C. màu đỏ;
D. không đổi màu.
Lời giải:
Đáp án đúng là: C
Phân tử khối của HCl nhỏ hơn của NaOH
=> phản ứng theo tỉ lệ mol 1 : 1 => HCl dư => Quỳ tím chuyển màu sang màu đỏ.
A. N2O;
B. NO2;
C. N2;
D. NO.
Lời giải:
Đáp án đúng là: C
Giả sử 1 mol khí trao đổi n mol electron.
Áp dụng bảo toàn e: 2nMg = n.n khí → Giá trị của n
+ n = 1 → NO2
+ n = 3 → NO
+ n = 8 → N2O
+ n = 10 → N2
Giải chi tiết:
nMg = 0,1 mol và nX = 0,02 mol
Giả sử 1 mol khí trao đổi n mol electron
Áp dụng bảo toàn e: 2nMg = n.n khí → 2.0,1 = 0,02.n → n = 10
→ Khí là N2.
A. 2,66.
B. 22,6.
C. 26,6.
D. 6,26.
Lời giải:
Đáp án đúng là: C
R2CO3 + BaCl2 → BaCO3 + 2RCl
Bảo toàn khối lượng m = 24,4 + 0,2.208 – 39,4 = 26,6.
Lời giải:
mmuối = mkim loại +
→ = mmuối – mkim loại = 6 – 2,28 = 3,72 (g)
→ VNO = 0,02. 24,79 = 0,4958 (l) = 495,8 (ml).
Lời giải:
Theo đề bài ta có
Gọi x ,y lần lượt là số mol của CO2 tham gia vào 2 phương trình:
Ta có PTHH :
(1)
(2)
Ta có hệ phương trình:
Câu 26: Cho 2,16 gam kim loại M hóa trị III tác dụng hết với dung dịch HNO3 loãng thu được 0,027 mol hồn hợp khí N2 và N2O. Hỗn hợp khí này có tỉ khối hơi so với H2 là 18,45. Tìm kim loại M, tính khối lượng muối thu được sau phản ứng.
Lời giải:
Gọi
Ta có :
nkhí = a + b = 0,027 (mol)
mkhí = 44a + 28b = M.n = 18,45.2.0,027 = 0,9963(gam)
Suy ra a = 0,015 ; b = 0,012
Bảo toàn electron :
→ nM = 0,08 (mol)
Vậy kim loại M là nhôm (Al).
Câu 27: Cho 200 ml dung dịch NaOH 1M tác dụng vừa đủ với 200 ml dung dịch HCl thu được dung dịch X.
a, Tính khối lượng muối có trong dung dịch X.
b, Tính nồng độ mol của dung dịch X.
Lời giải:
nNaOH = V. CM = 0,2. 1 = 0,2 (mol)
PTHH:
a. mNaCl = n. M = 0,2. (23 + 35,5) = 11,7 (g)
b.
A. 24 gam NaH2PO4 và 28,4 gam Na2HPO4;
B. 12 gam NaH2PO4 và 28,4 gam Na2HPO4;
C. 24 gam NaH2PO4 và 14,2 gam Na2HPO4;
D. 12 gam NaH2PO4 và 14,2 gam Na2HPO4.
Lời giải:
Đáp án đúng là: B
Ta có: nH3PO4= 0,3 mol; nNaOH = 0,5 mol
Ta có 1 < T = nNaOH/ nH3PO4 =1,67 <2
→ NaOH tác dụng với H3PO4 theo 2 PTHH:
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
Đặt = x mol; = y mol
Ta có = x+ y = 0,3 mol; nNaOH = x + 2y = 0,5 mol
→ x =0,1; y = 0,2
→ = 12gam; =28,4 gam.
A. 0,01M và 0,01M.
B. 0,02M và 0,04M.
C. 0,04M và 0,02M.
D. 0,05M và 0,05M.
Lời giải:
Đáp án đúng là: D
Dung dịch X có: = 0,2a mol; nHCl = 0,2. 0,1 = 0,02 mol
→ + nHCl = 0,4a + 0,02 (mol); = 0,2a mol
Dung dịch Y có: = 0,3b mol; nKOH = 0,3. 0,05 = 0,015 mol
→ + nKOH = 0,6b + 0,015 (mol); = 0,3b mol
Dung dịch Z có pH = 12 nên dư → (M) → (M)
→ dư = Vdd.CM = 0,5. 10-2 = 0,005 mol
Ta có: = 0,01 mol
Xét 2 trường hợp sau:
*TH1: phản ứng hết
Khi đó = 0,01 mol → 0,3b = 0,01 → b = 1/30
→ 0,6b + 0,015 = 0,035 mol
H+ + OH- → H2O
Ban đầu 0,4a + 0,02 0,035 mol
Phản ứng 0,4a + 0,02 0,4a + 0,02 mol
Sau phản ứng 0 0,035 – (0,4a + 0,02) mol
Ta có: dư = 0,035 – (0,4a + 0,02) = 0,005 mol → a = 0,025 (không thỏa mãn điều kiện )
*TH2: phản ứng hết
Khi đó = 0,01 mol → 0,2a = 0,01 → a = 0,05
→ = 0,4a + 0,02 = 0,04 (mol)
H+ + OH- → H2O
Ban đầu 0,04 (0,6b + 0,015)
Phản ứng 0,04 0,04
Sau phản ứng 0 0,6b – 0,025
Ta có: dư = 0,6b – 0,025 = 0,005 mol → b = 0,05
Vậy a = 0,05 và b = 0,05.
a. Viết phương trình hoá học xảy ra và tính phần trăm khối lượng của Fe trong hỗn hợp A.
b. Thổi khí CO qua hỗn hợp A nung nóng một thời gian thu được chất rắn B và 4,4 gam khí CO2. Tính khối lượng chất rắn B?
Lời giải:
Fe + H2SO4 → FeSO4 + H2
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
b.
Bảo toàn khối lượng:
a) Tính % theo khối lượng mỗi chất trong hỗn hợp đầu.
b) Tính thể tích dung dịch HCl 36% ( D = 1,18 g/ml) để hoà tan vừa đủ hỗn hợp đó.
Lời giải:
a. Gọi số mol Al và Al2O3 là a và b
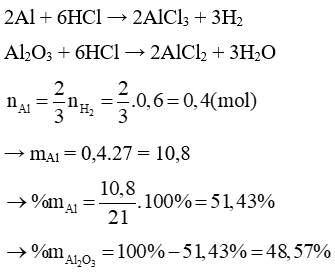
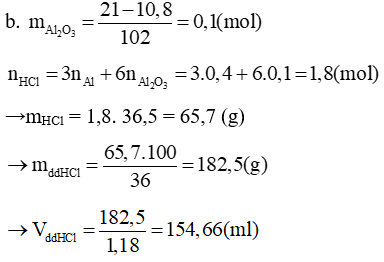
a. Tính thành phần% về khối lượng của mỗi kim loại trong hỗn hợp
b. Tính nồng độ % của dung dịch muối sau phản ứng.
Lời giải
a.
Chỉ có Fe tác dụng với dung dịch HCl
mFe = 0,3.56 = 16,8 (g)
%mCu = 100% - 72,41% = 27,58%.
b.
mdd sau = 16,8 + 100 – 0,3.2 = 116,2 (g)
Lời giải
Phương trình:
Theo đề bài ra, ta có:
mCuO = 0,1.80 = 8(g)
b.
Câu 34: Cho 24 gam canxi tác dụng với H2SO4 có trong dung dịch loãng.
a) Tìm thể tích khí hiđro sinh ra (ở đktc)
b) Tìm khối lượng của H2SO4
c) Tìm khối lượng của CaSO4 tạo thành sau phản ứng.
Lời giải:
a) Phương trình: Ca + H2SO4 → CaSO4 + H2
Theo phương trình:
b) Theo phương trình:
c. Theo phương trình:
Lời giải:
Phương trình: Fe + 2HCl → FeCl2 + H2
Theo phương trình:
→mFe = 0,2.56 = 11,2 (g)
→ mCu = 24 – 11,2 = 12,8 (g).
Lời giải:
Gọi a và b là số mol của Zn và Fe
Mặt khác, ta có: 65a + 56b = 25,1 (2)
Giải (1) và (2) ta có: a = 0,03 mol; b = 0,01 mol
→mFe = 0,01.56 = 0,56 (g)
→%mZn = 77,689%.
Lời giải:
Gọi số mol NO và NO2 là a và b
Ta có a + b = 0,4
Theo bảo toàn e: (1)
→ 3a + b = 0,8 (2)
Giải (1) và (2), ta được: a = b = 0,2 mol.
Theo bảo toàn N
A. NO2;
B. NO;
C. N2;
D. N2O.
Lời giải:
Đáp án đúng là: B
Bảo toàn electron ta có:
0,15. 2 = 0,1. (5 – n) → n = 2
Vậy khí X là NO.
Lời giải:
nNaOH = 0,1. 0,4 = 0,04 (mol)
nKOH = 0,1. 0,6 = 0,06 (mol)
Ta có:
→ Tạo 2 muối trung hoà và muối axit
Ta có hệ phương trình:
mmuối =
mmuối = 0,04.23 + 0,06.39 + 0,04.40 + 0,12.61 + 0,03.60 = 13,98 (g).
Lời giải:
Bảo toàn nguyên tố H:
→mmuối = 3,56 + 0,08.96 = 11,24 (g).
Câu 41: Cho 3,92 gam bột sắt vào 200 ml dung dịch CuSO4 10% (D = 1,12 g/ml)
a. Tính khối lượng kim loại mới tạo thành.
b. Tính nồng độ mol của chất có trong dung dịch sau phản ứng.
Lời giải:
Phương trình: Fe + CuSO4 → FeSO4 + Cu
Lập tỉ lệ: → Fe phản ứng hết, CuSO4 dư
nCu = nFe = 0,07 (mol) →mCu = 0,07.64 = 4,48 (g).
Sau phản ứng thu được dung dịch gồm:
FeSO4:
CuSO4 dư:
Lời giải:
Các phương trình xảy ra:
Ca(OH)2 + CO2 → CaCO3 + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
(3)
Theo phương trình (1):
Theo phương trình (2), (3):
Lời giải:
(1)
(2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (3)
Theo phương trình (3):
Gọi a và b lần lượt là số mol của Fe2O3 và FeO
a. Viết phương trình phản ứng có thể đã xảy ra.
b. Tính m và phần trăm khối lượng của Al và Fe trong X?
Lời giải:
a. Phương trình phản ứng có thể xảy ra:
Al + Fe(NO3)3 → Al(NO3)3 + Fe
Al + 3AgNO3 → Al(NO3)3 + 3Ag
Fe + 3AgNO3 → Fe(NO3)3 + 3Ag
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
b.
Dung dịch Y chứa (a mol), (b mol), (c mol) và (0,525 mol)
Bảo toàn điện tích, ta có: 3a + 3b + 2c = 0,525 (1)
Kim loại tách ra khỏi dung dịch là Ag (0,075 mol)
→mAg = 0,075.108 = 8,1 (g)
Bảo toàn kim loại, ta có:
3,07 + 0,15.56 + 0,075.108 = 27a + 56(b + c) + 0,075.108 (2)
mrắn = (3)
Giải hệ (1), (2), (3), ta được: a = 0,01; b = 0,095; c = 0,105.
a) Tìm tên kim loại đó
b) Tính nồng độ % của dung dịch thu được.
Lời giải:
2M + 2H2O → 2MOH + H2↑
Theo phương trình:
nLiOH = nLi = 0,48 (mol) →mLiOH = 0,48.24 = 11,52 (g)
mdd = 3,33 + 100 – 0,48 = 102,85 (g)
Lời giải:
Gọi chung 2 muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II là RCO3
RCO3 + 2HCl → RCl2 + CO2 + H2O
TH1: Dư Ca(OH)2
Ca(OH)2 + CO2 → CaCO3 + H2O
Vậy muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II là MgCO3 ( a mol) và CaCO3 ( b mol)
TH2: Có Ca(HCO3)2
Bảo toàn Ca: 0,04 + = 0,045 (mol)
→ = 0,005 (mol)
→
Vậy muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II là BeCO3 ( a mol) và MgCO3 ( b mol)
B. 450;
C. 500;
D. 900.
Lời giải
Đáp án đúng là: B
Phương trình chung: MO + H2SO4 → MSO4 + H2O
Áp dụng bảo toàn khối lượng, ta có:
moxit + = mmuối +
→30,2 + 0,001V.98 = 66,2 + 0,001.18
→V = 450 (ml)
A. 42gam;
B. 39 gam;
C. 34,5gam;
D. 48gam.
Lời giải:
Đáp án đúng là: B
Bảo toàn khối lượng:
mX = 30 + 0,25.98 – 0,25.44 = 39 gam
Bảo toàn khối lượng:
mmuối (X) = mmuối cacbonat +
= 30 + 0,25.98 – 0,25.44 – 0,25.18 = 39 gam.
Lời giải:
Chất rắn B là Cu, chất rắn E gồm 2 oxit, nên:
nCuO = nCu = 0,15 (mol)
Gọi a và b lần lượt là số mol của kim loại R và FeO
mX = a.MR + 72b + 80×0,15 = 37,2 (1)
→nR = + nCu → a = 0,3 + 0,15 = 0,45 (2)
E gồm RO (a mol) và Fe2O3 (b/2 mol)
(3)
Từ (1), (2) và (3)
Vậy R là magie (Mg)
Mg + 2HCl → MgCl2 + H2
FeO + 2HCl → FeCl2 + H2O
nHCl (ban đầu) = 2 (mol)
nHCl (dư) = 2 – 0,45.2 – 0,2.2 = 0,7 (mol)
Câu 50: Cho 38,7 gam hỗn hợp kim loại Cu, Zn tan hết trong dung dịch HNO3 loãng dư, sau phản ứng thu được 8,96 lít khí NO ở đktc (sản phẩm khử duy nhất)
a) Xác định% khối lượng mỗi kim loại trong hỗn hợp
b) Tính thể tích dung dịch HNO3 đã dùng biết dùng dư 20% số lượng cần dùng
c) Tính khối lượng muối thu được sau phản ứng.
Lời giải:
Gọi mol Cu là a; số mol Zn là b
Theo bài 64a + 65b = 38,7 (1)
nNO = 0,4 mol
Theo BT(e) 2nCu + 2nZn = 3nNO => 2a + 2b = 0,3.4 (2)
(1,2) => a = b = 0,3 mol
a,
%mZn = 100% − 49,61% = 50,39%
b, Theo BTNT co:
Vì dùng dư 20% số lượng cần dùng =>
Tính thể tích thiếu dữ kiện.
c, Khối lượng muối thu được sau phản ứng là:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.