Top 1000 câu hỏi thường gặp môn Hóa Học có đáp án (phần 17) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa Học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 17)
Lời giải:
Vì : Dung dịch + NaOH → Kết tủa
→ Dung dịch có chứa: Ba(HCO3)2
Bảo toàn nguyên tố C:
A. 0,05M và 0,06M;
B. 0,04M và 0,06M;
A. 0,04M và 0,08M;
A. 0,06M và 0,09M.
Lời giải:
Đáp án đúng là: B
Bảo toàn nguyên tố P:
→ 2 muối sản phẩm là: K2HPO4 và K3PO4
Đặt
Bảo toàn nguyên tố K và P, ta có hệ:
Câu 3: Cho vào bình kín 0,2 mol N2 và 0,8 mol H2 với xúc tác thích hợp. Sau một thời gian thấy tạo ra 0,3 mol NH3. Hiệu suất phản ứng được tổng hợp là:
B. 56,25%;
C. 75,8%;
D. kết quả khác.
Lời giải:
Đáp án đúng là: A
(trong điều kiện p, to, xúc tác thích hợp)
Ban đầu: 0,2…..0,8……….0 (mol)
Phản ứng: 0,15..0,45………0,3 (mol)
Kết thúc: 0,05…0,35………0,3 (mol)
Nhận thấy: → Hiệu suất tính theo N2
Lời giải:
Gọi kim loại là M suy ra oxit là MO
Giả sử có 1 mol MO.
Phản ứng xảy ra:
MO + 2HCl → MCl2 + H2O
nHCl = 2nMO = 2 mol→ mHCl = 2.36,5 = 73 gam
→
BTKL: mdd sau phản ứng = mMO + mdd HCl = 1.(MM + 16) + 730 = MM + 746 (g)
Vậy M là Mg, suy ra oxit là MgO.
Lời giải:
Gọi hóa trị của R là n
PTHH : 2R + nH2SO4 → R2(SO4)n + nH2
Theo PTHH:
⇒ MR = 9n
Ta có bảng sau :
|
n |
I |
II |
III |
|
MR |
9 |
18 |
27 |
|
KL |
Loại |
Loại |
Al |
Vậy R là kim loại Al.
Lời giải:
PTHH: Mg + 2HCl → MgCl2 + H2
x……2x……...x……….x (mol)
Zn + 2HCl → ZnCl2 + H2
y……2y……...y………y (mol)
Ta có hệ phương trình:
mmuối
a) Tính % về khối lượng của từng kim loại có trong hỗn hợp
b) Dẫn toàn bộ lượng khí trên qua 16 gam bột CuO đun nóng đến pư kết thúc. Tính m Cu thu được?
Lời giải:
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2
a…….3a………………..3/2a (mol)
Fe + 2HCl → FeCl2 + H2
b……2b………………b (mol)
Theo đề bài ra, ta có hệ:
a) mAl = 27.0,2 = 5,4 (g)
mFe = 11 – 5,4 = 5,6 (g)
b) Ta có số mol HCl là:
nHCl = 3.0,2 + 2.0,1 = 0,8 (mol)
Lời giải:
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
Theo PTHH (1):
→ mAl = 0,2.27 = 5,4 (g)
→
A: 75%;
B: 72%;
C: 56%;
D: 28%.
Lời giải:
Đáp án đúng là: B
PTHH:
Fe + 2HCl → FeCl2 + H2
0,1……………………0,1 (mol)
Câu 10: Cho 200 gam dung dịch BaCl2 10,4% tác dụng vừa đủ với 400 gam dung dịch Na2SO4
b) Tính khối lượng kết tủa tạo thành?
c) Tính nồng độ phần trăm của các chất còn lại trong dung dịch thu được sau khi đã lọc bỏ kết tủa?
Lời giải:
a) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
b)
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,1………………..0,1 (mol)
c) Dung dịch còn lại là NaCl
Áp dụng định luật bảo toàn khối lượng:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,1…………………………….0,2 (mol)
mNaCl = 0,2.58,5 = 11,7 (g)
Lời giải:
Tỉ lệ về thể tích bằng tỉ lệ về số mol
Coi số mol mỗi khí ban đầu là 1
Ban đầu: 1 1
Phản ứng: 0,6 → 0,2 → 0,4
Cân bằng: 0,4 0,8 0,4
Số mol hỗn hợp sau phản ứng: 0,4 + 0,8 + 0,4 = 1,6 (mol
Lời giải:
Ta có nkhí = 0,14 mol
→ nN (trong khí) = nkhí = 0,14 mol
Bảo toàn N → trong muối = 0,44 - 0,14 = 0,3 mol
Ta có mCu = 0,7m mà khối lượng rắn = 0,75m
→ Fe phản ứng chưa hết → muối tạo thành là Fe(NO3)2
BTKL → m - 0,75m = 0,25m = 0,15.56
→ m = 33,6 gam.4
Lời giải:
PTHH: CuO + H2SO4 → CuSO4 + H2O
0,2…..0,2……….0,2 (mol)
CM của dung dịch muối là:
mdd = 196 + 16 = 212 (g)
Câu 14: Phát biểu nào sau đây sai?
A. Bản chất của sự điện phân là phản ứng oxi hoá – khử xảy ra trên bề mặt điện cực dưới tác dụng của dòng điện;
B. Để bảo vệ tàu biển làm bằng thép người ta gắn tấm Zn vào vỏ tàu ở phần chìm trong nước biển. Bản chất của việc làm này là sử dụng biện pháp ăn mòn điện hoá để chống ăn mòn kim loại.
C. Bản chất của sự ăn mòn hoá học là phản ứng oxi hoá – khử xảy ra trong đó kim loại bị oxi hoá có phát sinh ra dòng điện.
D. Dung dịch đất trồng trọt chua có màu vàng là do các hợp chất Fe (III) gây nên.
Lời giải:
Đáp án đúng là: C
Trong quá trình ăn mòn hoá học thì kim loại chuyển electron trực tiếp vào các chất trong môi trường và không phát sinh dòng điện → C sai
Trong quá trình điện phân thì dưới tác dụng của dòng điện bên anot xảy ra quá trình nhường electron, bên catot xảy ra quá trình nhận electron → xảy ra phản ứng oxi hoá khử trên bề mặt điện cực → A đúng
Để bảo vệ tàu biển làm bằng thép người ta gắn tấm Zn vào vỏ tàu ở phần chìm trong nước biển. Zn có tính khử mạnh hơn Fe và tốc độ ăn mòn chậm hơn → được dùng làm kim loại hi sinh để bảo vệ sắt (bảo vệ điện hoá) → B đúng
Các hợp chất Fe (III) thường có màu vàng → D đúng.
A. O2;
B. CO2;
C. H2;
D. N2.
Lời giải:
Đáp án đúng là: A
Trong công nghiệp, nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng. Sau khi đã loại bỏ CO2 và hơi nước, không khí được hoá lỏng dưới áp suất cao và nhiệt độ thấp. Nâng dần nhiệt độ không khí lỏng đến – 1960C thì nitơ sối và được tách khỏi oxi lỏng vì oxi có nhiệt độ sôi sao hơn (- 1830C). Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
Câu 16: Viết phương trình chứng minh CO2 có tính oxi hoá?
Lời giải:
CO2 có phản ứng oxi hóa với một số chất có tính khử mạnh như C; Mg...
Câu 17: Trong các phát biểu sau, phát biểu đúng là:
A. Điện tích của electron bằng điện tích của nơtron;
B. Khối lượng của proton bằng điện tích của nơtron;
C. Điện tích của proton bằng điện tích của nơtron;
D. Có thể chứng minh sự tồn tại của electron bằng thực nghiệm.
Lời giải:
Đáp án đúng là: D
A. 4;
B. 5;
C. 6;
D. 3.
Lời giải:
Đáp án đúng là: D
Các thí nghiệm làm thay đổi số oxi hoá của kim loại là:
3Cl2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaCl + 4H2O ()
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3 ()
2CrCl2 + Cl2 → 2CrCl3 ()
A. KClO
B. KClO3
C. KClO4
D. KClO2
Lời giải:
Đáp án đúng là: B
Cho khí Cl2 tác dụng với dung dịch KOH, đun nóng, thu được dung dịch chứa muối KCl và muối KClO3
Tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hoá và số nguyên tử clo đóng vai trò chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là:
A. 1 : 5;
B. 5 : 1;
C. 1 : 3;
D. 3 : 1.
Lời giải:
Đáp án đúng là: B
Clo vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử
Câu 21: Cân bằng phương trình:
Lời gải:
A. 24,19%;
B. 51,63%;
C. 75,81%;
D. 48,37%.
Lời gải:
Đáp án đúng là: D
Đặt công thức của Na2CO3 và (NH4)2CO3 là X2CO3.
Công thức chung của CaCl2 và BaCl2 là YCl2
Phản ứng: X2CO3 + YCl2 → YCO3 + 2XCl
Khi 1 mol YCl2 phản ứng tạo thành YCO3 khối lượng giảm 11 gam
mgiảm = 43 – 39,7 = 3,3 (g)
→ Ba2+ và Ca2+ đã kết tủa hết
Đặt số mol BaCl2 và CaCl2 là a và b
→ số mol BaCO3 và CaCO3 tạo thành cũng là a và b
Giải hệ:
Câu 23: Hoàn thành phương trình:
Lời gải:
Phản ứng không xảy ra nên không có phương trình trên.
Lời giải:
Đánh số thứ tự và trích mẫu thử các dung dịch:
Cho dung dịch NaOH vào mẫu thử, đun nhẹ:
- Nhận ra MgCl2 tạo kết tủa trắng
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
- Nhận ra NaNO3 do không có hiện tượng gì
- NH4Cl và NH4NO3 tạo khí mùi khai thoát ra:
NH4Cl + NaOH → NH3↑ + H2O + NaCl
NH4NO3 + NaOH → NH3↑ + H2O + NaNO3
Cho dung dịch AgNO3 vào mỗi mẫu thử:
- Nhận ra NH4Cl tạo kết tủa trắng:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- Nhận ra NH4NO3.
Lời giải:
Dùng HCl, đun nóng có thể nhận biết được cả 4 oxit trên.
+ CuO tan trong HCl và tạo dung dịch có màu xanh lam
CuO + 2HCl → CuCl2 + H2O
+ MnO2 tan, sinh ra khí màu vàng lục, mùi hắc
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
+ FeO tan trong HCl và tạo dung dịch có màu xanh nhạt
FeO + 2HCl → FeCl2 + H2O
+ Ag2O tan trong HCl, tạo dung dịch có kết tủa trắng
Ag2O + 2HCl → 2AgCl↓ + H2O
Câu 26: Có 7 lọ đựng 7 dung dịch mất nhãn được đánh số từ (1) đến (7) gồm: (NH4)2CO3, BaCl2, MgCl2, H2SO4, Ba(OH)2, NaOH, Na2CO3. Thực hiện các thí nghiệm được kết quả như sau:
- Chất (1) tác dụng với chất (4) hoặc (5) đều tạo ra kết tủa; tác dụng với chất (2) hoặc (7) đều tạo ra khí.
- Chất (2) tác dụng với chất (4) hoặc (5) đều tạo ra kết tủa, tác dụng với chất (3) tạo ra khí; tác dụng với chất 6 thì tạo ra cả kết tủa lẫn khí.
- Chất (5) tác dụng với chất (3), (6) hoặc (7) đều tạo ra kết tủa.
- Chất (7) tác dụng với chất (4) hoặc (6) đều tạo ra kết tủa. Hãy biện luận để xác định các chất từ (1) đến (7).
Lời giải:
Lập bảng:
|
(NH4)2CO3 |
BaCl2 |
MgCl2 |
H2SO4 |
Ba(OH)2 |
NaOH |
Na2CO3 |
|
|
(NH4)2CO3 |
↓ |
↓ |
↑ |
↓; ↑ |
↑ |
||
|
BaCl2 |
↓ |
↓ |
↓ |
||||
|
MgCl2 |
↓ |
↓ |
↓ |
↓ |
|||
|
H2SO4 |
↑ |
↓ |
↓ |
↑ |
|||
|
Ba(OH)2 |
↓; ↑ |
↓ |
↓ |
↓ |
|||
|
NaOH |
↑ |
↓ |
Không hiện tượng |
||||
|
Na2CO3 |
↓ |
↓ |
↑ |
↓ |
Theo đề bài:
1: H2SO4
2: (NH4)2CO3
3: NaOH
4: BaCl2
7: Na2CO3
5: MgCl2
6: Ba(OH)2
A. 1;
B. 2;
C. 3;
D. 4.
Lời giải:
Đáp án đúng là: C
Theo Bron – stet, bazơ là những chất nhận proton (nhận )
Lời giải:
CTHH đúng là: MgO, Na2O, Cu(OH)2, K2CO3, H2SO4
CTHH sai là: CaCl, Fe3O2 NaHPO4, Al3(SO4)2.
Sửa CTHH sai: CaCl2, Fe2O3, Na2HPO4, Al2(SO4)3.
Câu 29: Có các phát biểu sau về nguyên tử:
(a) Điện tích của hạt proton bằng điện tích hạt electron.
(b) Khối lượng hạt proton bằng khối lượng hạt electron.
(c) Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
(d) Khoảng không gian giữa vỏ nguyên tử và hạt nhân là một vùng trống rỗng.
(e) Trong cùng một nguyên tử luôn có số hạt proton bằng số hạt electron.
Số phát biểu SAI là:
A. 4;
B. 3
C. 2;
D. 1.
Lời giải:
Đáp án đúng là: C
(a) sai vì điện tích của hạt proton là luôn dương(+), còn electron thì lại là (-). nói chúng bằng nhau là sai, nếu muốn nói đúng thì phải là "số điện tích hạt proton bằng số điện tích hạt electron"
(b) sai vì khối lương của proton nặng hơn nhiều khối lượng của electron (mproton ≈ 1,67.10-24 (g); melectron ≈ 9,11.10-27 (g)).
Lời giải:
Trích dẫn mẫu thử:
− Đổ từ từ đến dư mẫu thử này vào mẫu thử còn lại.
Nếu ban đầu không có hiện tượng gì 1 thời gian sau xuất hiện kết tủa tăng dần tới lớn nhất sau đó bị hòa tan thì ban đầu là B, chất đổ vào là A.
KOH + HCl → KCl + H2O
3KOH + AlCl3 → 3KCl + Al(OH)3↓
KOH + Al(OH)3 → KAlO2 + 2H2O
⇒ Dán nhãn vào các chất vừa nhận biết.
Câu 31: Có mấy loại kim loại đen? Làm thế nào để phân biệt kim loại đen?
Lời giải:
Kim loại đen thành phần chủ yếu sắt (Fe) hợp chất cacbon (C).
Dựa vào tỉ lệ cacbon và các nguyên tố tham gia người ta chia kim loại đen thành 2 loại: Gang (tỉ lệ C > 2,14%) và thép (tỉ lệ C < 2,14%).
Câu 32: Có một oxit sắt chưa rõ công thức. Chia oxit này làm hai phần bằng nhau :
- Hòa tan hết phần 1 phải dùng 150 ml dung dịch HCl 3M
- Cho một luồng CO dư đi qua phần II nung nóng, phản ứng xong thu được 8,4g sắt.
Tìm công thức oxit sắt trên.
Lời giải:
Gọi CTHH của oxit sắt là FexOy
Ta có: x : y = 0,15 : 0,225 = 2 : 3
Vậy oxit sắt cần tìm là Fe2O3.
Câu 33: Có một oxit sắt chưa rõ công thức, chia oxit thành hai phần bằng nhau:
a) Để hòa tan hết phần 1 cần dùng 150 ml dung dịch HCl 1,5M
b) Cho luồng khí H2 dư vào phần 2 nung nóng, phản ứng xong thu được 4,2 gam Fe.
Tìm công thức oxit sắt.
Lời giải
Gọi CTHH của oxit sắt là FexOy
Ta có: x : y = 0,075 : 0,1125 = 2 : 3
Vậy oxit sắt cần tìm là Fe2O3.
Lời giải
Không phải mọi sự biến đổi các chất đều thuộc lĩnh vực hóa học
Ví dụ:
- Biển đổi thuỷ năng thành điện năng là biển đổi vật lí.
- Nghiền nhỏ đá vôi thành vôi bột là biến đổi vật lí.
Lời giải
PTHH:
Áp dụng định luật bảo toàn khối lượng, ta có:
Câu 36: Thực hiện chuỗi phản ứng:
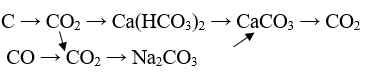
Lời giải:
CO2 + Ca(OH)2 → Ca(HCO3)2
CO2 + 2NaOH → Na2CO3 + H2O
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
A. C2H4 và C4H8;
B. CH4 và C2H6;
C. C3H4 và C5H8;
D. CH4 và C3H8.
Lời giải:
Đáp án đúng là: D
→ → 2 hiđrocacbon là ankan
→
→ Có 1 ankan có số C < 2 và 1 ankan có số C > 2
→ 2 ankan thoả mãn là CH4 và C3H8.
Câu 38: Cho các quá trình sau:
(1) Quá trình hô hấp của sinh vật;
(2) Quá trình thối rữa của các xác sinh vật;
(3) Quá trình đốt cháy nhiên liệu;
(4) Quá trình quang hợp của cây xanh.
CO2 được sinh ra trong những quá trình nào?
A. (1), (3), (4);
B. (1), (2), (3);
C. (1), (2), (3), (4);
D. (1), (2), (4).
Lời giải:
Đáp án đúng là: B
Lời giải:
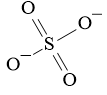
Câu 40: Công thức cấu tạo của CO2 là:
A. O – C – O;
B. C – O – O;
C. O = C = O;
D. O = C – O.
Lời giải:
Đáp án đúng là: C
Cấu hình electron nguyên tử của C (Z = 6): 1s22s22p2.
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4.
Nguyên tử C cần thêm 4 electron để đạt được cấu hình bền vững của khí hiếm gần nhất; nguyên tử O cần 2 electron để đạt được cấu hình của khí hiếm gần nhất.
→Mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron chia đều cho 2 nguyên tử O.
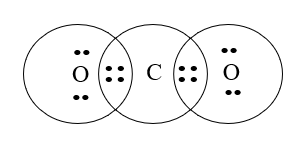
→ Công thức cấu tạo của CO2 là O=C=O.
Lời giải:
Ta có:
x là hóa trị của (SO4) vậy x = 2
y là hóa trị của Fe vậy y = 3 hoặc y = 2
Do x, y khác nhau suy ra y = 3.
Vậy ta có phương trình phản ứng
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
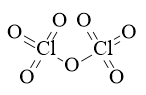
Câu 42: Viết công thức electron và công thức cấu tạo của Cl2O7?
Lời giải:
Công thức electron:
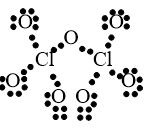
Công thức cấu tạo
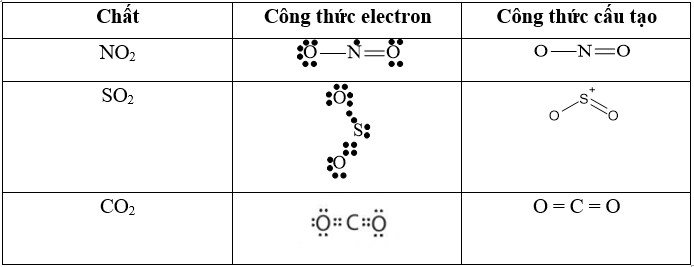
Câu 43: Viết công thức electron và công thức cấu tạo của NO2, SO2, CO2?
Lời giải:
Câu 44: Viết công thức electron và công thức cấu tạo của H2CO3?
Lời giải:
|
Chất |
Công thức electron |
Công thức cấu tạo |
|
H2CO3 |
|
|
Câu 45: Công thức Lewis biểu diễn cấu tạo của NO2 là
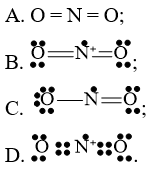
Lời giải:
Đáp án đúng là: C
Bước 1: Tổng số electron hóa trị trong phân tử = 1.5 + 2.6 = 17 electron
Bước 2: Trong phân tử NO2, nguyên tử N cần 3 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh: O – N – O
Bước 3: Mỗi nguyên tử O cần 6 electron hóa trị để đạt octet:
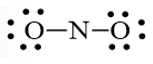
Bước 4: Số electron hóa trị còn lại là 17 – 6.2 – 2.2 = 1
Mà nguyên tử N chưa đạt octet nên 1 nguyên tử O sẽ dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử N và trên nguyên tử N vẫn còn 1 electron chưa tham gia liên kết.
Công thức Lewis của NO2 là
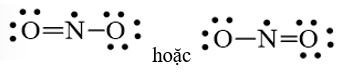
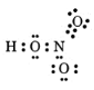
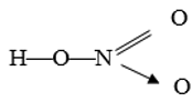
a. Viết công thức electron, công thức cấu tạo của CO2.
b. Giải thích sự hình thành liên kết trong phân tử KCl. Viết phương trình phản ứng biểu diễn sự di chuyển electron.
Lời giải:
a. Công thức electron là O :: C :: O
Công thức cấu tạo của là O = C = O
b. Giải thích sự hình thành liên kết trong phân tử KCl, viết phương trình phản ứng biểu diễn sự di chuyển electron.
K → K+ + 1e
Cl + 1e → Cl-
K+ + Cl- → KCl
2K + Cl2 → 2KCl
Lời giải:
- Công thức electron:
- Công thức cấu tạo:
- Nguyên tố nitơ có hoá trị 4 và số oxi hoá +5
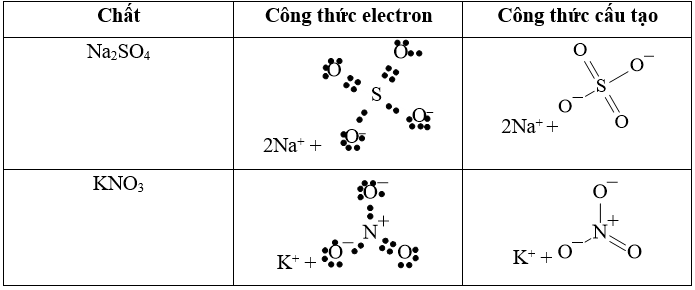
Câu 48: Viết công thức electron và công thức cấu tạo của: Na2SO4, KNO3?
Lời giải:
Câu 49: Viết công thức VSEPR và dự đoán hình học của các phân tử sau:
a) SO3
b) PH3
Lời giải:
a) Từ công thức Lewis của SO3
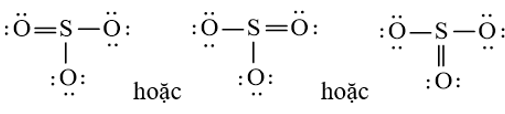
⇒ Công thức VSEPR của SO3 là: AX3
⇒ SO3 có dạng tam giác phẳng.
b) Công thức Lewis của PH3 là
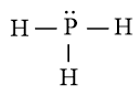
⇒ Công thức VSEPR của PH3 là: AX3E1
⇒ Để giảm tối đa lực đẩy giữa 4 cặp electron hóa trị (gồm 3 cặp electron chung và 1 cặp electron riêng), 4 cặp electron này phải chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất. Tuy nhiên cặp electron riêng đẩy mạnh hơn làm góc liên kết giảm, nên nhỏ hơn 109,5o
Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2
Sau khi cân bằng phương trình hóa học trên, tổng hệ số nguyên tối giản của các chất phản ứng là:
A. 116;
B. 36;
C. 106;
D. 16.
Lời giải:
Đáp án đúng là: B
Cr2S3 + 15Mn(NO3)2 + 20K2CO3 → 2K2CrO4 + 3K2SO4 + 15K2MnO4 + 30NO + 20CO2
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.