Top 1000 câu hỏi thường gặp môn Hóa Học có đáp án (phần 18) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa Học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 18)
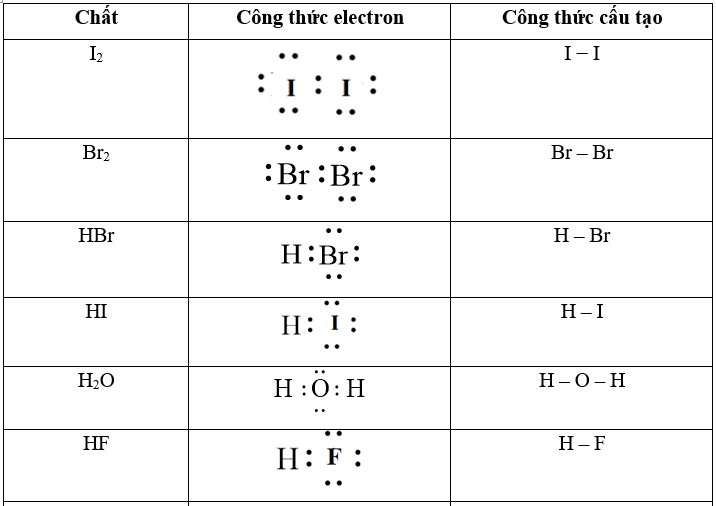
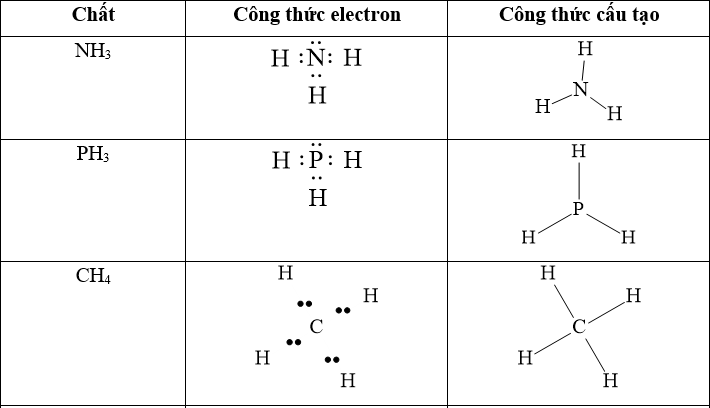
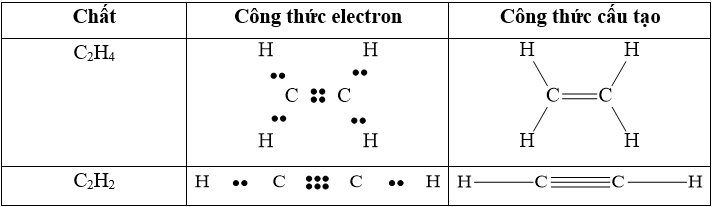
Câu 1: Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Lời giải:
|
Chất |
HClO |
HCN |
HNO2 |
|
Công thức electron |
|
|
|
|
Công thức cấu tạo |
|
|
|
Lời giải:
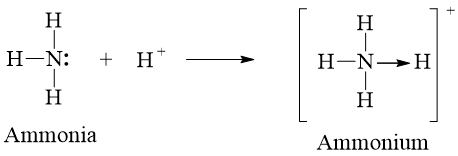
Câu 3: Trình bày liên kết cho – nhận trong ion NH4+.
Lời giải:
Trong phân tử NH3, lớp ngoài cùng của nguyên tử N có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không chứa electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử N đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành ion NH4+. Khi đó, liên kết cho – nhận được hình thành, trong đó nguyên tử N là nguyên tử cho, ion H+ đóng vai trò nhận electron. Trong ion NH4+, bốn liên kết N – H hoàn toàn tương đương nhau.
Câu 4: Lập công thức hoá học tạo bởi Ca và
Lời giải:
CTHH dạng chung: Cax(CO3)y
Theo quy tắc hóa trị: x × II = II × y
Chuyển thành tỉ lệ:
⇒ x=1; y=1
Vậy CTHH là CaCO3.
Câu 5: Cu → CuO → CuSO4 → CuCl2 → Cu(NO3)2 → Cu(OH)2 → CuO → Cu
Lời giải:
(1) 2Cu + O2 2CuO
(2) CuO + H2SO4 → CuSO4 + H2O
(3) CuSO4 + BaCl2 → BaSO4↓ + CuCl2
(4) CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
(5) Cu(NO3)2 + 2NaOH → Cu(OH)2↓+ 2NaNO3
(6) Cu(OH)2 CuO + H2O
(7) CuO + H2 Cu + H2O.
Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
Hệ số cân bằng của Cu2S và HNO3 trong phản ứng là :
A. 1 và 22;
B. 1 và 14;
C. 1 và 10;
D. 1 và 12.
Lời giải:
→ Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Câu 7: CuCl2 rắn tác dụng với H2SO4 đặc được không?
Lời giải:
CuCl2 rắn không tác dụng với H2SO4 đặc vì không thoả mãn điều kiện của phản ứng trao đổi. (Phản ứng trao đổi chỉ xảy ra khi có 1 chất kết tủa hoặc 1 chất bay hơi).
Câu 8: CuCl2 có tác dụng với Na2SO4 được không?
Lời giải:
Phản ứng giữa 2 muối là phản ứng trao đổi, mà phản ứng trao đổi chỉ xảy ra khi có 1 chất kết tủa hoặc 1 chất bay hơi
Ở đây nếu trao đổi với nhau thì tạo thành CuSO4 và NaCl, mà 2 chất này không phải là chất rắn (không kết tủa)
⇒ Vậy nên CuCl2 không tác dụng được với Na2SO4.
Câu 9: Cân bằng thăng bằng electron phản ứng sau:
CuFeSx + O2 Cu2O + Fe3O4 + SO2
Lời giải:
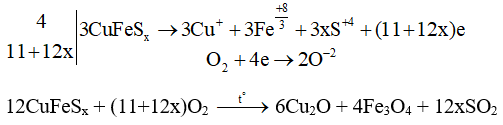
Câu 10: SO2 có tác dụng với CuO không?
Lời giải:
Vì SO2 là oxit axit. Oxit axit chỉ tác dụng với oxit của bazo tan mà CuO là oxit của bazo không tan nên SO2 không tác dụng với CuO.
Câu 11: Cho CuO tác dụng với axit HCl sẽ có hiện tượng
A. Không có hiện tượng gì.
B. CuO tan tạo thành dung dịch có màu xanh lam;
C. Tạo chất khí làm đục nước vôi trong;
D. Tạo chất khí cháy được trong không khí.
Lời giải:
Đáp án đúng là: B
CuO + 2HCl → CuCl2 + H2O
→ CuO tan, tạo thành dung dịch có màu xanh lam.
Câu 12: Phản ứng Cu với dung dịch HNO3 đặc, nóng xảy ra như sau:
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Sau khi cân bằng, nếu hệ số của Cu là 3 thì hệ số của HNO3 tương ứng là:
A. 8;
B. 9;
C. 12;
D. 15.
Lời giải:
Đáp án đúng là: C
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Sau khi cân bằng, nếu hệ số của Cu là 3 thì hệ số của HNO3 tương ứng là 12.
Câu 13: CuSO4 có tác dụng với NaCl được không?
Lời giải:
CuSO4 không tác dụng với NaCl.
Đây là phản ứng giữa hai muối nên cần phải bảo đảm điều kiện 2 muối tham gia phản ứng phải tan và sản phẩm muối sinh ra có ít nhất 1 muối không tan.
Mà hai chất ở trên khi tác dụng với nhau chỉ sinh ra muối tan.
→ Do đó, phản ứng ở trên chưa đảm bảo đủ điều kiện sản phẩm nên không xảy ra.
A. 12
B. 2,3
C. 2
D. 13
Lời giải
Đáp án đúng là: B
2NaCl + CuSO4 Cu + Cl2 + Na2SO4
0,015 0,015
CuSO4 + H2O Cu + ½ O2 + H2SO4
0,005 0,005 (mol)
→ pH = -lg[H+] = 2,3.
Lời giải
0,01 mol X phản ứng với 0,04.0,25 = 0,01 mol NaOH
1,5 g X phản ứng với 0,08.0,25 = 0,02 mol NaOH
⇒ 1,5 g X ứng với 0,02 mol X
Câu 16: CxHyOz + O2 CO2 + H2O.
Cân bằng và giải thích cách cân bằng?
Lời giải:
Để bảo toàn nguyên tố với C: Điền x vào CO2
Để bảo toàn nguyên tố với H: Điền vào H2O
Sau phản ứng, tổng số nguyên tử O:
Gọi a là hệ số cân bằng của O2
Trước phản ứng, số nguyên tử O là :
z + 2a
Để bảo toàn nguyên tố với O thì :
Vậy phương trình sau khi cân bằng là :
Lời giải:
Đáp án đúng là: D
Khối lượng chất rắn giảm là do O bị Y lấy đi
bị lấy =
nC = nY – nX = 0,3x
Bảo toàn electron: 4nC = 2nO → 4.0,3x = 0,24.2 → x = 0,4.
Câu 18: Dãy các chất tác dụng với được với BaCl2
A. Fe, Cu, NaOH, CuSO4;
B. Fe, Cu, HCl, CuSO4;
C. NaOH, CuSO4;
D. H2SO4 loãng, CuSO4.
Lời giải:
Đáp án đúng là: D
Dãy các chất tác dụng với được với BaCl2 là H2SO4 loãng, CuSO4.
BaCl2 + H2SO4 loãng → BaSO4↓ + 2HCl
BaCl2 + CuSO4 → BaSO4↓ + CuCl2
Câu 19: Dãy các chất nào dưới đây được sắp xếp theo chiều tăng dần số oxi hóa của nitơ?
A. NO, N2O, NH3, ;
B. , N2, N2O, NO, NO2, ;
C. NH3, N2, NO2, NO, ;
D. NH3, NO, N2O, NO2, N2O5.
Lời giải:
Đáp án đúng là: B
a, NO, N2O, NH3,
|
NO |
N2O |
NH3 |
|
|
+2 |
+1 |
-3 |
+5 |
⇒ Sắp xếp theo chiều số oxi hóa tăng dần: NH3, N2O, NO,
b, , N2, N2O, NO, NO2,
|
|
N2 |
N2O |
NO |
NO2 |
NO3- |
|
-3 |
0 |
+1 |
+2 |
+4 |
+5 |
⇒ Sắp xếp theo chiều số oxi hóa tăng dần: NH4+, N2, N2O, NO, NO2,
c, NH3, N2, NO2, NO,
|
NH3 |
N2 |
NO2 |
NO |
|
|
-3 |
0 |
+4 |
+2 |
+5 |
⇒ Sắp xếp theo chiều số oxi hóa giảm dần: NH3, N2, NO, NO2,
d, NH3, NO, N2O, NO2, N2O5
|
NH3 |
NO |
N2O |
NO2 |
N2O5 |
|
-3 |
+2 |
+1 |
+4 |
+5 |
⇒ Sắp xếp theo chiều số oxi hóa tăng dần: NH3, N2O, NO, NO2, N2O5
Câu 20: Dãy gồm các chất đều bị thủy phân khi tan trong nước là
A. AlCl3, Na3PO4, K2SO3;
B. Na3PO4, Ba(NO3)2, KCl;
C. NaNO3, Mg(NO3)2, Ba(NO3)2;
D. K2S, KHS, KHSO4.
Lời giải:
Đáp án đúng là: D
AlCl3 → Al3+ + 3Cl-
Al3+ + 3H2O ⇄ Al(OH)3 + 3H+
Na3PO4 → 3Na+ + PO43-
PO43- + H2O ⇄ HPO42- + OH-
K2SO3 →2K+ + SO32-
SO32- + H2O ⇄ HSO3- + OH-
Câu 21: Dãy gồm các chất khí nhẹ hơn không khí là:
A. CO2, H2, O3;
B. SO2, Cl2, N2;
c. NO2, H2, SO3;
d. NH3, H2, CH4.
Lời giải:
Đáp án đúng là: D
Các chất nhẹ hơn không khí có M < 29 g/mol
Câu 22: Dãy gồm các hợp chất đều có liên kết cộng hóa trị là
A. KCl, CaO;
B. HCl, CO2;
C. NaCl, Al2O3;
D. CaCl2, Na2O.
Lời giải:
Đáp án đúng là: B
HCl, CO2 là các hợp chất cộng hóa trị.
Câu 23: Dãy nào gồm các chất là đơn chất?
A. CaO; Cl2; CO; CO2;
B. N2; Cl2; C; Fe;
C. CO2; MgCl2; CaCO3; HCl;
D. Cl2; CO2; Ca(OH)2; CaSO4.
Lời giải:
Đáp án đúng là: B
Đơn chất là những chất chỉ tạo bởi một nguyên tố hóa học.
Ví dụ: N2; Cl2; C; Fe;
Câu 24: Dãy gồm các ion cùng tồn tại trong một dung dịch là:
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: C
Các ion cùng tồn tại trong một dung dịch gồm các ion không thể tác dụng với nhau.
Loại A vì
Loại B vì
Loại D vì
Câu 25: Dãy ion nào sau đây có thể tồn tại trong cùng một dung dịch?
B. K+, OH-, Ba2+, HCO3-.
C. NH4+, Ba2+, NO3-, OH-.
D. HSO4-, NH4+, Na+, NO3-.
Lời giải:
Đáp án đúng là: D
Các ion cùng tồn tại trong một dung dịch gồm các ion không thể tác dụng với nhau.
Loại A vì
Loại B vì
Loại D vì
A: Al, Zn, Cu;
B: Fe, Mg, Al;
C: Mg, Zn, Ag;
D: Zn, Mg, Cu.
Lời giải:
Đáp án đúng là: B
Tất cả các kim loại đều tác dụng được với dung dịch axit clohidric, axit sunfuric loãng ở điều kiện thường phải đứng trước H trong dãy hoạt động hoá học của kim loại.
Loại A vì có Cu.
Loại C vì có Ag.
Loại D vì có Cu.
A. 2,24% hoặc 84,32%;
B. 2,24% hoặc 15,68%;
C. 15,68% hoặc 97,76%;
D. 84,32% hoặc 97,76%.
Lời giải:
Đáp án đúng là: D
Ta có = 2.0,02 = 0,04 mol; = 0,01 mol
Ta có nên có 2 trường hợp:
- TH1: Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Theo PT (1): = 0,01 mol
→ = 0,01.22,4 = 0,224 lít
→ % = 2,24% → % = 100% - 2,24% = 97,76%.
- TH2: Ca(OH)2 phản ứng hết:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,01 0,01 0,01 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2
2.0,03 (0,04 – 0,01) mol
Ta có: = 0,01+ 2.0,03= 0,07 mol →= 0,07.22,4=1,568 lít
→%= 15,68%→ %= 100% - 15,68% = 84,32%.
Lời giải:
Dẫn khí CO chứ không phải CO2
CO + CuO Cu + CO2 (1)
Hỗn hợp khí thu được gồm CO dư và CO2. Cho hỗn hợp khí hấp thụ vào dung dịch Ba(OH)2 thì CO2 sẽ phản ứng.
CO2 + Ba(OH)2 → BaCO3↓ + H2O
→ = 0,3 (mol)
Theo pư (1) ta thấy nCuO = → mCuO = 0,3.80 = 24 gam.
Câu 29: Dẫn 3,36 lít khí etilen ở đktc qua dung dịch chứa 20 gam brom. Hiện tượng quan sát được là:
A. Màu vàng của dung dịch không thay đổi;
B. Màu vàng của dung dịch brom nhạt hơn lúc đầu;
C. Màu vàng nhạt dần và dung dịch chuyển thành trong suốt;
D. Màu vàng sẽ đậm hơn lúc đầu.
Lời giải:
Đáp án đúng là: C
Xét → C2H4 dư
→ Br2 sẽ bị nhạt màu hoàn toàn và chuyển thành màu trong suốt.
Lời giải:
nNaOH = 0,2.1 = 0,2 (mol)
Suy ra chỉ tạo ra 1 muối trung hoà, dư
Lời giải:
PTHH: CO2 + 2NaOH → Na2CO3 + H2O
Theo PTHH:
A. 39,4.
B. 7,88.
C. 3,94.
D. 19,70.
Lời giải
Đáp án đúng là: D
nNaOH = 0,1.1 = 0,1 (mol)
→ Tạo 2 muối
Ba2+ + CO32- → BaCO3↓
0,1 0,1 0,1 (mol)
→ = m↓ = 0,1. 197 = 19,7 (g).
A. 14,84 gam;
B. 18,96 gam;
C. 16,96 gam;
D. 16,44 gam.
Lời giải
Đáp án đúng là: A
→ Chỉ tạo ra 1 muối trung hoà
PTHH: CO2 + 2NaOH → Na2CO3 + H2O
Theo PTHH:
Câu 34: Dãy nào dưới đây chỉ các chất tinh khiết?
A. Kim loại bạc, nước cất, đường kính.
B. Nước sông, nước đá, nước chanh.
C. Nước biển, đường kính, muối ăn.
D. Khí tự nhiên, gang, dầu hỏa.
Lời giải
Đáp án đúng là: A
Chất tinh khiết là chất không có lẫn chất khác. Vậy kim loại bạc, nước cất, đường kính là các chất tinh khiết.
Câu 35: Dung dịch HNO3 đặc, không màu, để ngoài ánh sáng lâu ngày sẽ chuyển thành:
A. màu trắng sữa;
B. màu vàng;
C. màu đen sẫm;
D. màu nâu.
Lời giải:
Đáp án đúng là: B
Axit HNO3 không bền lắm. Khi để ngoài ánh sáng bị phân hủy chậm theo phản ứng:
4HNO3 → O2 + 2H2O + 4NO2↑ (màu nâu đỏ)
- Trong dung dịch NO2 làm cho lọ đựng axit HNO3 có màu vàng.
a. Viết phương trình hóa học.
b. Tính khối lượng sản phẩm thu được.
c. Tính thể tích oxi cần dùng (đktc).
d. Tính khối lượng KClO3 cần dùng để khi phân hủy thì thu được một thể tích khí O2 (ở đktc) bằng với thể tích khí O2 đã sử dụng ở phản ứng trên.
Lời giải:
a) PTHH:
b)
Theo PTHH:
c)
d)
Theo PTHH:
Câu 37: Đốt cháy photpho trong không khí thu được 42,6 gam P2O5.
a) Tính khối lượng photpho?
b) Để có lượng oxi trên cần bao nhiêu gam KClO3?
c) Vẫn lượng oxi trên đem oxi hóa 16,8 gam sắt. Sau phản ứng thu được bao nhiêu gam Fe3O4 biết hiệu suất là 90%?
Lời giải:
a)
PTHH:
→ mP = 0,6.31 = 18,6 (g).
b)
c)
Nên hiệu suất tính theo số mol Fe.
nFe phản ứng = 0,3.90% = 0,27 (mol)
A. 2,24 lít;
B. 3,36 lít;
C. 1,12 lít;
D. 4,48 lít.
Lời giải:
Đáp án đúng là: D
Vì este no đơn chức mạch hở nên có cùng công thức phân tử dạng CnH2nO2
Khi đốt cháy este no đơn chức mạch hở → = 0,2 mol → V = 4,48 lít.
A. 18;
B. 36;
C. 9;
D. 27.
Lời giải:
Đáp án đúng là: A
Vì este no đơn chức mạch hở nên có cùng công thức phân tử dạng CnH2nO2
Khi đốt cháy este no đơn chức mạch hở → = 0,1 mol
→ .
Lời giải:
PTHH:
Theo PTHH:
%C trong thép là:
Câu 41: Đốt cháy hoàn toàn a mol amino axit X thu được 2a mol CO2 và 0,5a mol N2. Amino axit X là:
A. H2NCH2COOH
B. H2N[CH2]2COOH
C. H2N[CH2]3COOH
D. H2NCH(COOH)2
Lời giải:
Đáp án đúng là: A
Giả sử X có dạng CxHyOzNt
= 2a mol.
= 2 × 0,5a = a mol.
số nguyên tử C là
số nguyên tử N là
Vậy amino axit X là: H2NCH2COOH.
A. C4H9N.
B. C2H7N.
C. C3H7N.
D. C3H9N.
Lời giải:
Đáp án đúng là: C
Vì đốt cháy amin đơn chức X (CxHyN) nên
= 0,3 mol.
Số nguyên tử C là
Số nguyên tử H là
Vậy CTHH của X là C3H7N.
Câu 43: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Lời giải:
3KOH + FeCl3 → 3KCl + Fe(OH)3
Sản phẩm Fe(OH)3 là kết tủa màu đỏ nâu.
A. CH4.
B. C2H6.
C. C2H4.
D. C2H2.
Lời giải:
Đáp án đúng là: C
⟹ Tỉ lệ C : H = 0,2 : 0,4 = 1 : 2
⟹ Công thức đơn giản nhất của X là CH2.
⟹ Công thức phân tử là C2H4.
Lời giải:
PTHH:
Gọi
Theo đề bài ra ta có hệ phương trình:
→ %VCO = 100% - 33,33% = 66,67%.
%mCO = 100% - 44% = 56%.
Câu 46: Dụng cụ làm bằng gang dùng chứa hóa chất nào sau đây ?
A. H2SO4 loãng;
B. dd CuSO4;
C. dung dịch MgSO4;
D. dung dịch H2SO4 đặc, nguội.
Lời giải:
Đáp án đúng là: D
Thành phần hoá học của gang bao gồm chủ yếu là sắt (hơn 95% theo trọng lượng), và các nguyên tố hợp kim chính là carbon, silic. Mà H2SO4 đặc, nguội vẫn có tính oxi hoá mạnh và vẫn phân li ra H+ bình thường nhưng với hoạt độ thấp. Mà lớp màng oxit sắt Fe2O3 (phủ ngoài kim loại) sinh ra từ phản ứng của Fe với H2SO4 đặc, nguội là dạng thù hình đặc biệt của Fe2O3. Với các loại oxit có kim loại hoá trị (III) thì có 3 loại thù hình cơ bản sau: Dạng alpha (dạng này bền vững – lục phương – còn gọi là corun), dạng beta (lục phương) và dạng gamma (lập phương dạng bát diện). Mà Fe2O3 rất chắc chắn nên có thể đựng được dung dịch H2SO4 đặc, nguội.
Lời giải:
Bảo toàn điện tích trong dung dịch ta có:
→ mmuối = 0,1.23 + 0,05.24 + 0,04.96 + 0,12.35,5 = 11,6 (g).
Câu 48: Dung dịch nào có khả năng dẫn điện:
A: Dung dịch đường;
B: Dung dịch rượu;
C: Dung dịch muối ăn;
D: Dung dịch benzen trong ancol.
Lời giải:
Đáp án đúng là: C
Muốn dẫn điện thì chất đó phải phân li ra các ion âm và dương.
- Đường C12H22O11 không phân li.
- Rượu: C2H5OH không phân li.
- C6H6 và C2H5OH không phân li.
- Muối ăn: NaCl → Na+ + Cl- dẫn điện được.
Câu 49: Dung dịch H2SO4 tác dụng với dãy chất nào sau đây:
A. Fe, CaO, HCl.
B. Cu, BaO, NaOH.
C. Mg, CuO, HCl.
D. Zn, BaO, NaOH.
Lời giải
Đáp án đúng là: D
Loại A vì có HCl không phản ứng với H2SO4.
Loại B vì có Cu không phản ứng với H2SO4.
Loại C vì có HCl không phản ứng với H2SO4.
Câu 50: Cho AgNO3 tác dụng với HCl sản phẩm của phản ứng có:
A. H2O;
B. AgCl;
C. NaOH;
D. H2.
Lời giải
Đáp án đúng là: B
AgNO3 + HCl → AgCl↓ + HNO3
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.