Top 1000 câu hỏi thường gặp môn Hóa Học có đáp án (phần 15) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa Học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 15)
a) Viết phương trình hóa học xảy ra.
b) Tính % khối lượng của các muối trong hỗn hợp G.
Lời giải: nAgNO3=0,5.1,4=0,7(mol)
Cho Mg dư vào dung dịch Z có khối lượng tăng so với kim loại Mg ban đầu ⇒ AgNO3 dư
Gọi số mol
MgCl2 + 2AgNO3 → 2AgCl↓ + Mg(NO3)2
NaCl + AgNO3 → AgCl↓ + NaNO3
NaBr + AgNO3 → AgBr↓ + NaNO3
Ta có:
→ 95a + 58,5b + 103c = 39,58 (1)
Và mAgCl + mAgBr = 93,22
→ 143,5(2a + b) + 188c = 93,22 (2)
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
nMg phản ứng = x (mol) → nAg = 2x (mol)
→mtăng = mAg – mMg
→ 9,6 = 108.2x – 24x
→ x = 0,05
phản ứng với G = 0,7 – 0,1 = 0,6 (mol)
Theo phương trình phản ứng với G → 2a + b + c = 0,6 = (3)
Giải hệ (1), (2), (3)
Lời giải:
Gọi R là kí hiệu trung bình của 2 kim loại
2R + 2H2O → 2ROH + H2
ROH + HCl → RCl + H2O
- Theo các PTHH ta có: nR = nROH = nHCl = 0,2 mol
-Ta có: MLi =7 < MR = 15 < MNa = 23
Vậy A là liti (Li).
- Phần 1: Cho tác dụng hoàn toàn với 90 ml dung dịch HCl 1M, sau phản ứng dung dịch làm quỳ tím hoá xanh.
- Phần 2: Cho tác dụng với V(ml) dung dịch HCl 1M sau phản ứng dung dịch không làm đổi màu quỳ tím
a. Tìm công thức phân tử oxit
b. Tính V
Lời giải:
a. Gọi công thức oxit kim loại hóa trị I: M2O
nHCl = 1.0,09 = 0,09mol
Phương trình phản ứng: M2O + 2HCl → 2MCl + H2O (1)
1,5/(2M + 16) 3/(2M + 16)
(1) suy ra: 3/(2M + 16) > 0,09 → M < 8,67
Suy ra: M là Li
b. (1/2 hỗn hợp) = 1,5/30 = 0,05 mol
Phương trình phản ứng: Li2O + 2HCl → 2LiCl + H2O (2)
0,05 0,1
(2) suy ra: V = 0,1/1 = 0,1 lít = 100 ml.
A. 30 và 70;
B. 35 và 65;
C. 75 và 25;
D. 90 và 10.
Lời giải:
Đáp án đúng là: C
PTHH: C2H4 + Br2 → C2H4Br2
Khi cho hỗn hợp khí trên qua dung dich brom thì C2H4 bị giữ lại trong bình
=> mbình tăng = = 1,4(g)
A. CH3OH;
B. C2H5OH;
C. C3H7OH;
D. C4H9OH.
Lời giải:
Đáp án đúng là: B
Giả sử ancol đơn chức, no, mạch hở là ROH
Theo tăng giảm khối lượng:
Vậy ancol đơn chức, no, mạch hở là: C2H5OH.
Lời giải:
Dung dịch X có muối NH4NO3
Xét sự thay đổi e ta có:
Bảo toàn e ta có:
Dung dịch X gồm 2 muối NH4NO3: 0,0125 mol; Mg(NO3)2: 0,2 mol
mX = 0,0125.80 + 0,2.148 = 30,6 (g).
A. 1,940;
B. 1,120;
C. 2,240;
D. 0,448.
Lời giải:
Đáp án đúng là: D
→ Số mol của Mg(NO3)2: 0,2 mol
Xét sự thay đổi e ta có:
Bảo toàn e ta có:
Câu 8: Cho 400 ml dung dịch KOH 0,1M vào 100 ml dung dịch H2SO4 0,1M thu được dung dịch Y.
a. Tính nồng độ mol của các ion trong Y?
b. Tính pH của dung dịch Y, xác định môi trường của dung dịch Y?
c. Tính thể tích dung dịch HCl 10% cần để trung hoà dung dịch Y biết D = 1,25 g/ml?
Lời giải:
a. nKOH = 0,4.0,1 = 0,04 (mol)
Vdd = 0,4 + 0,1 = 0,5 (l)
b.
Vậy môi trường của dung dịch Y là bazơ.
c. Phương trình: HCl + KOH → KCl + H2O
→nHCl = nKOH dư = 0,02 (mol)
→mHCl = 0,02.36,5 = 0,73 (g)
Câu 9: Cho 40 ml dung dịch HCl 0,75M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được là:
A. 10;
B. 12;
C. 3;
D. 2.
Lời giải:
Đáp án đúng là: B
nHCl = 0,04.0,75 = 0,03 mol; ;
nKOH = 0,16.0,04 = 0,0064 (mol)
Lập tỉ lệ: dư
Lời giải
Ta có: mNaOH = 44.10% = 4,4 (g)
Ta có:
Vậy phản ứng tạo 2 muối: Na3PO4; Na2HPO4
3NaOH + H3PO4 → Na3PO4 + 3H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
Bảo toàn khối lượng:
+ mmuối
→mmuối = 4,4 + 3,92 – 0,11.18 = 6,34 (g).
Lời giải:
Ta quy đổi: C4H10 = 3H2 + 2C2H2
Ta có: x + y + z = 0,225 (1)
Bảo toàn nguyên tố C: 3x + 2y = 0,6 (2)
→ x+ 2y – z = 0,2 (3)
Từ (1) (2) (3) ta được:
Nếu cho 7,56 lít (đktc) hỗn hợp A đi qua bình đựng dung dịch Br2
Tỉ lệ: nên trong 7,56 lít (đktc) hỗn hợp A có C3H6: 0,285 mol; C2H2: 0,0225 mol; H2: 0,03 mol
Với , C2H2: b mol; H2: c mol ta có hệ phương trình:
A. 5,1 gam;
B. 10,2 gam;
C. 1,2 gam;
D. 20,4 gam.
Lời giải:
Đáp án đúng là: B
nAl = 5,4/27 = 0,2 mol.
Phương trình hoá học:
4Al + 3O2 → 2Al2O3.
Theo phương trình hoá học có:
Bảo toàn khối lượng:
Lời giải:
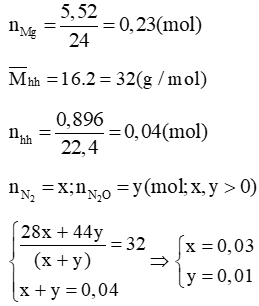
Dung dịch thu được có thể chứa NH4NO3: a (mol)
Quá trình nhường e
Quá trình nhận e

ne nhận =
Bảo toàn e ta có:
0,46 = 0,38 = 8a
→ a = 0,01 (mol)
→ = 0,01 (mol)
Vậy dung dịch thu được gồm: Mg(NO3)2: 0,23 (mol) và NH4NO3: 0,01 (mol)
Cô cạn thu được mrắn = = 0,23.148 + 0,01.80 = 34,84 (g)
Câu 14: Cho 5,6 gam Fe tác dụng với lượng dư dung dịch AgNO3 thu được m gam chất rắn. Giá trị m là:
A. 21,6;
B. 10,8;
C. 27,0;
D. 32,4.
Lời giải:
Đáp án đúng là: A
Vì Fe tác dụng với lượng dư dung dịch AgNO3 nên chỉ xảy ra phản ứng sau:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Theo phương trình: nAg = 2nFe = 2.0,1 = 0,2 (mol)
→mAg = 0,2.108 = 21,6 (g).
Lời giải:
Đáp án đúng là: D
Gọi kim loại cần tìm là A, oxit của kim loại A, hoá trị II là AO
Phương trình: AO + 2HCl → ACl2 + H2O
Ta có:
Theo phương trình:
Vậy A là canxi (Ca).
Lời giải
Do M thuộc nhóm IA nên M có hóa trị I
PTHH: 2M + 2HCl → 2MCl + H2
Vậy M là Na (Sodium).
Lời giải
Phương trình: SO2 + Br2 + 2H2O → 2HBr + H2SO4
Theo phương trình:
Khi cho Cu và Al tác dụng với H2SO4 đặc nguội thì chỉ có Cu phản ứng:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Theo phương trình trên:
→mCu = 0,05.64 = 3,2 (g)
→mAl = 5,9 – 3,2 = 2,7 (g)
Tổng số mol của hỗn hợp 2 kim loại trên là 0,05 + 0,1 = 0,15 (mol).
Câu 18: Cho 5,6 gam Fe tác dụng với 500 ml dung dịch HNO3 0,8M. Sau phản ứng thu được V lít hỗn hợp khí A gồm N2O và NO2 có tỉ khối so với H2 là 22,25 và dung dịch B.
a. Tính V (đktc)
b. Tính CM các chất trong dung dịch B.
Lời giải:
a. Đặt x, y lần lượt là số mol của N2O và NO2.
PTHH xảy ra:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O (1)
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O (2)
Theo PTHH (1), (2),
Tỉ lệ thể tích các khí trên là:
Gọi a là thành phần % theo thể tích của khí N2O
Vậy (1 – a) là thành phần % của khí NO2
Ta có: 44a + 46(1 – a) = 22,25.2 = 44,5
→ a = 0,75 hay % của khí N2O là 75% và của khí NO2 là 25%
Tỉ lệ về thể tích cũng là tỉ lệ về số mol nên x = 3y (**)
Giải (*), (**) ta được x = 0,036, y = 0,012
Vậy thể tích của các khí thu được là:
V = ( 0,012 + 0,036).22,4 = 1,08 (l)
b.
Vậy nồng độ các chất trong dung dịch là:
A. Mg;
B. Ca;
C. Fe;
D. Ba.
Lời giải:
Đáp án đúng là:
Gọi hoá trị của kim loại M là n ( )
PTHH: 2M + 2nHCl → 2MCln + nH2
Theo phương trình:
Với n = 2 thì MM = 24 (g/mol)
Vậy M là magie (Mg).
Lời giải:
Sau phản ứng, hỗn hợp khí gồm O2 (dư) và N2
Gọi
Ta có :
nkhí = a + b = = 0,3 (mol)
mkhí = 32a + 28b = 0,3.15.2 = 9(gam)
⇒ a = 0,15; b = 0,15
Gọi
Ta có :
mkhí =
⇒ 32a + 0,15.28 = (a + 0,15).15,6.2
⇒ a = 0,6
⇒ = a − 0,15 = 0,6 − 0,15 = 0,45(mol)
Gọi hóa trị của Y là n
4Y + nO2 2Y2On
Theo phương trình, ta có :
Với n =1thì MY = 32,5 (loại)
Với n = 2 thì MY = 65 (Zn)
Với n = 3 thì MY = 97,5 (loại)
Vậy Y là kim loại Zn (kẽm).
a. Xác định 2 kim loại kiềm
b. Tính khối lượng 2 hiđroxit thu được
c. Tính V dung dịch H2SO4 1M cần trung hòa hết 2 hiđroxit này.
Lời giải:
a) 2M + 2H2O → 2MOH + H2
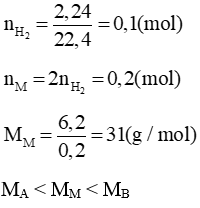
→ A: Natri (Na), B: Kali (K)
b) Hỗn hợp: Na (a mol), K (b mol)
nNaOH = nNa = 0,1 (mol)
mNaOH = 0,1.40 = 4 (g)
nKOH = nK = 0,1 (mol)
mKOH = 0,1.56 = 5,6 (g)
c. 2NaOH + H2SO4 → Na2SO4 + 2H2O
2KOH + H2SO4 → K2SO4 + 2H2O
A. 42%;
B. 28%;
C. 50%;
D. 56%.
Lời giải:
Đáp án đúng là: B
Bảo toàn nguyên tố C, ta có:
A. 1,344;
B. 0,896;
C. 15,933;
D. 0,672.
Lời giải:
Đáp án đúng là: A
nCu = 0,1 mol; = 0,24 mol; = 0,12 mol.
⇒ H+ hết ⇒ nNO = 0,06 mol ⇒ V = 1,344 lít.
a/. Tính khối lượng CuO trong hỗn hợp ban đầu ?
A. 2,4;
B. 4,0;
C. 6,0;
D. Kết quả khác.
b/ Tính nồng độ mol các chất trong dd sau phản ứng ? Biết thể tích dung dịch không thay đổi.
A. 4M; 1,8M;
B. 1,5M; 1M;
C. 2M; 4M;
D. 0,31M; 0,18M.
Lời giải:
a/ Đáp án đúng là: A
a/ nNO = 0,6 (mol)
→ ne nhận = 3nNO = 1,8 (mol)
→ nCu = ne nhận : 2 = 0,9 (mol)
→ mCu = 0,9.64 = 57,6 (g) → mCuO = 60 – 57,6 = 2,4 (g).
b/ Đáp án đúng là: D
b/ nCuO = 0,03 (mol)
= ne nhận + nNO + 2nCuO = 1,8 + 0,6 + 2.0,03 = 2,46 (mol)
→ dư = 3 – 2,46 = 0,54 (mol)
Lời giải:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Fe + 2HCl → FeCl2 + H2↑
ZnS + 2HCl → ZnCl2 + H2S↑
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CaSO3 + 2HCl → CaCl2 + SO2↑ + H2O
9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO↑+ 6H2O
CaC2 + 2HCl → CaCl2 + CH≡CH↑
Al4C3 + 12HCl → 4AlCl3 + 3CH4↑
Na2O2 + 2HCl → 2NaCl + H2O + ½ O2↑
A. 11,36 gam;
B. 5,5 gam;
C. 10,65 gam;
D. 9,94 gam.
Lời giải:
Đáp án đúng là: C
Hỗn hợp rắn X gồm P2O5 (x mol) và P2O3 (y mol);
= 0,075.142 = 10,65 gam.
Câu 27: Cho 7,8 gam hỗn hợp hai kim loại Al và Mg vào dung dịch HCl dư thu được 8,96 lít khí H2
a) Viết các phương trình phản ứng xảy ra
b) Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu
c) Tính khối lượng muối thu được sau phản ứng.
Lời giải:
1,
2, Đặt a = nAl, b = nMg
Ta có:
→ nAl = 0,2 mol → mAl = 5,4 (g)
→ %Al = 69,23%, %Mg= 30, 76%
3, mmuối = = 0,2.133,5 + 0,1. 95 = 36,2 (g).
A. 0,8 mol;
B. 0,4 mol;
C. 0,3 mol;
D. 0,25 mol.
Lời giải:
Đáp án đúng là: A
Nhận xét: Kim loại + HCl → muối + H2
Ta có: mdung dịch tắng = mkim loại – mkhí thoát ra
= 7,8 – 7 = 0,8 (gam)
Áp dụng bảo toàn nguyên tố H:
Lời giải:
2A + Cl2 → 2ACl ( vì A hóa trị I → ACl)
2 1 2 ( mol)
Ta có: nA = nACl
→ MA = 39 (g/mol)
Vậy A là kali (K).
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.